ハイスループットスクリーニング(HTS)
創薬におけるハイスループットスクリーニング
創薬におけるハイスループットスクリーニング
薬物標的が同定された後(遺伝子研究で特定された、特定の疾患に関連するタンパク質など)、次のステップは、そのタンパク質に対する薬物(つまり、生体内で標的を阻害し、疾患を治癒または緩和する化合物)を同定することです。この段階は創薬と呼ばれ、通常は6〜10年かかります。
創薬ワークフローは、候補となる数千の化合物の中から、標的に対する最終的な薬剤を1つ特定することを目的としています。最初の創薬開発では、数百から数千の化合物のライブラリから、標的と相互作用する有望な化合物(ヒット)を特定することが含まれます。これらのヒットの結合相互作用(多くの場合、結合速度を含む)が確認され、さらにリードへと発展します。最後の手順は、安定性、溶解性、結合性などの特性を改善することによって、リードを医薬品に開発することです。
ハイスループットスクリーニング(HTS)は、(半)自動化された方法で特定の特性について、多数の化合物をスクリーニングする実験ワークフローです。初期の創薬開発では、HTSはヒットの同定中によく使用されます。たとえば、低分子のライブラリをスクリーニングして、薬物標的との相互関係を調べるために使用されます。ハイスループットとして認定されるためにスクリーニングする必要がある化合物の数については、決まった定義はありません。ただし、通常は千~数千の化合物が使用されます。
ハイスループットの薬剤スクリーニングでは、後続するワークフローにおける化合物の数を大幅に減らす必要がありますが、高品質のヒットを同定する必要もあります(偽陽性と偽陰性を回避)。ヒットを確認してリードに発展させるには、時間とコストがかかります。そのため、研究者はヒット数が多すぎることを望んでいませんが、HTSを厳格にしすぎて潜在的な薬剤を逃したくもありません。
初期の創薬開発ワークフローは、さまざまなレベルで自動化できます。創薬におけるHTSは、液体処理装置によるサンプル調製から、測定自体、結果の分析と搬送にまで及びます。
液体処理装置は、サンプル調製(移動、希釈、添加、インキュベーションなど)に必要なピペット作業を行います。サンプルは通常、複数のウェルプレート(96またはその倍数のウェル)で調製され、その後、測定(化合物ライブラリの標的への結合速度の測定など)を実行および観察する装置に移されます。
規模や用途に応じて、装置間のプレートの移動は、ロボットまたは手動で行われます。複数の測定は、1つまたは複数の装置で順に実行される場合があります。最終的には、測定から生成されたデータを分析し、出力して報告する必要があります。
WAVEsystem は、 グレーティング結合干渉法(GCI) 技術に基づいており、初期の創薬開発に、速度論的結合データを提供することが可能です。同じ親和性を持つ相互作用は非常に異なる反応速度を持つ可能性があるため、 結合速度 ( k a)と 解離定数 ( k d)速度に関する速度論的データは、親和性のみのデータよりも多くの情報を提供します。そのため、創薬開発の初期段階で、親和性だけではなく、速度論的結合に関するデータを取得すると、どのヒットを継続するかをより適切に選択できるようになります。
独自のwaveRAPID®法は、他の方法よりも迅速にこの速度論的データを取得できるため、スループットが向上し、速度論的スクリーニングが可能になります。実際のスループットは用途によって異なります。たとえば、高速反応速度で低分子を測定する場合、一般的に抗体見られる遅い相互作用を測定する場合よりも、必要な時間は短くなります。
さらに、waveRAPID®を使用すると、単一のウェルからの結合速度の測定が可能になり、サンプル調製プロセスの一部(希釈系列)が不要になります。
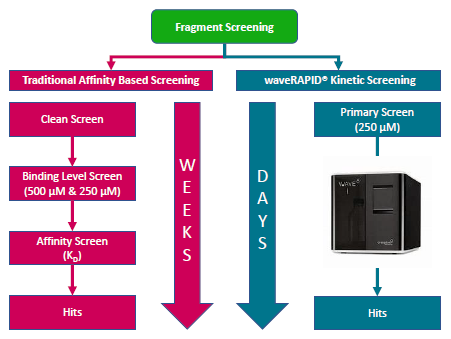
従来の親和性ベースのスクリーニングワークフローと、waveRAPID®の速度論的スクリーニングワークフローを並行して実行します。waveRAPID®のワークフローには、フラグメントの簡単かつ時間効率の高いスクリーニングを可能にするWAVEdeltaシステムが含まれています。
HTSは、創薬研究を加速するカギとなります。HTS中に作成されたデータの品質(どのヒットを継続するかを決定するために使用)が、プロセスの成功を決定します。HTSを実行する場合、偽陽性を回避することと偽陰性を除外しないことの両方が重要です。
HTSによってさらなる開発のために同定された化合物の量は、医薬品開発に向けて必要な労力に影響します。
親和性だけでなく、結合速度に関するデータを早期に取得すると、これらのヒットを同定して開発する際に、より多くの情報に基づいた意思決定を行うことができます。

WAVEsystem創薬およびライフサイエンス向けの次世代バイオ解析装置で、産業研究と学術研究の両方に対応 |
|
|---|---|