グレーティング結合干渉法(GCI)
生体分子間相互作用の研究に革命をもたらします
反応速度(キネティックス)ガイド | WAVEシステムによる結合反応速度(キネティックス). Download now
Download now生体分子間相互作用の研究に革命をもたらします

独自のグレーティング結合干渉法(GCI)技術を中心に開発されたWAVEsystemは、導波管干渉に基づいて構築されているため、従来の表面プラズモン共鳴と比較して優れた信号および時間分解能を実現します。これにより、研究者は高速かつ正確にカイネティクス速度を測定し、親和性定数を決定して、生体液などの粗サンプル中の相互作用検体の濃度が低くても監視できるようになります。比類のない柔軟性と高感度を備えたこのWAVEは、まったく新しいアプリケーションの世界にラベルフリー定量化をもたらし、生体分子間相互作用の研究に革命を起こします。
GCIは、2015年からラボ用デバイスのWAVEファミリで市販されている最先端の生物物理学的特性評価法です。
![[GCI_CX_weblandscape.jpg] GCI_CX_weblandscape.jpg](https://dam.malvernpanalytical.com/b266ecf3-637f-41d5-a36a-ae29010df43c/GCI_CX_weblandscape_Original%20file.jpg)
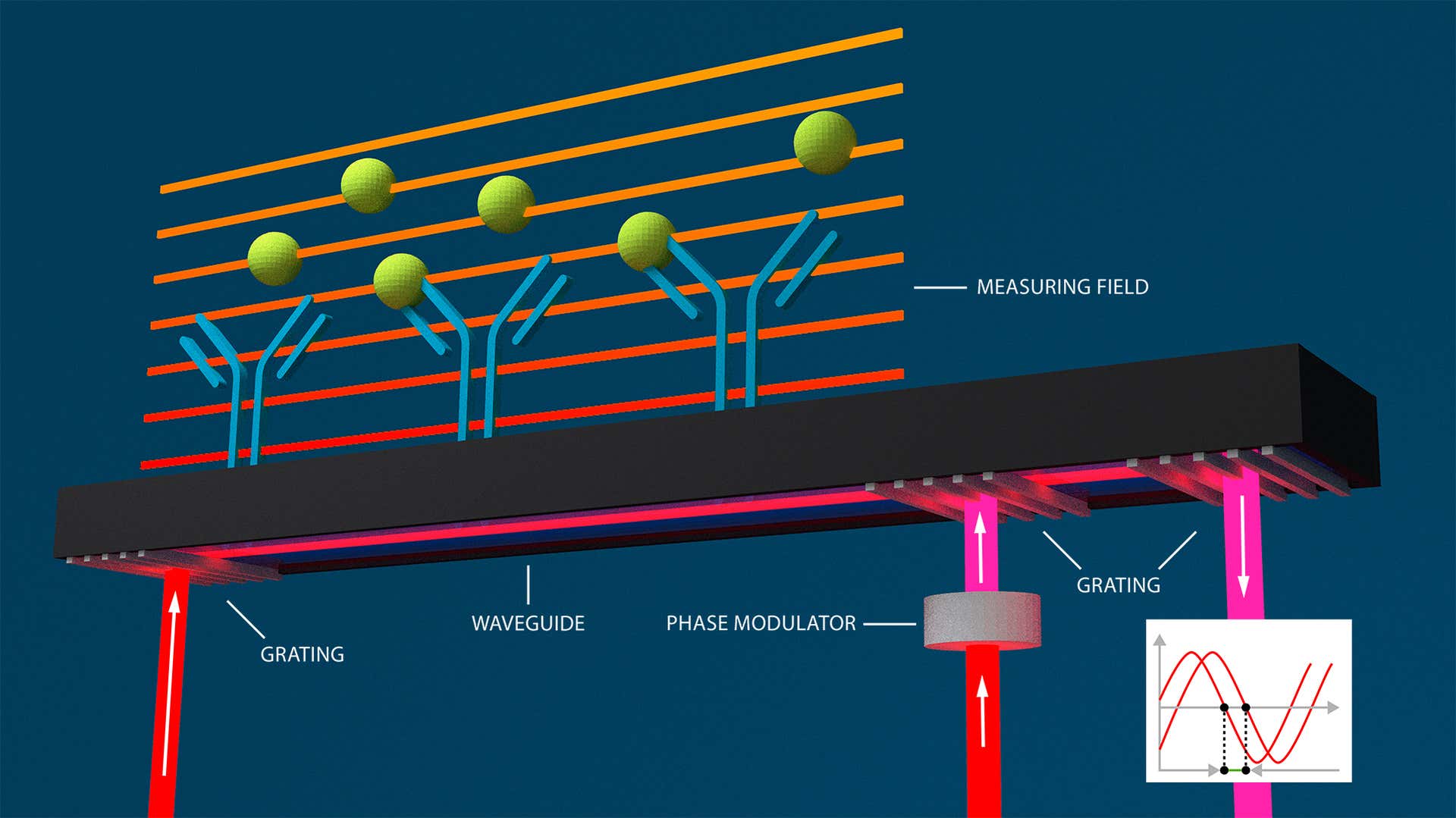
当社の特許取得済みのグレーティング結合干渉法設計は、表面プラズモン共鳴の感度レベルを超えるために、導波管干渉の本質的な利点を活かしながら、さらに高めています。導波管干渉と同様に、エバネッセント場のサンプル深部への浸透が少なく、導波管の、光とサンプル間の相互作用長が長くなっています。そのため、信号対ノイズ比が向上します(0.01 pg/mm2未満)。
ただし、Creoptix GCI読み出し方式には、CCDカメラに投影されるのではなく、時間領域および導波管内でインタフェログラムが作成されるという利点があります。時間依存位相シフト信号として、センサー表面の屈折率変化を測定することで、従来の導波干渉や表面プラズモン共鳴に比べてより堅牢な読み出しが可能になり、温度ドリフトや振動の影響を受けず、信号と時間のより優れた分解能を実現することができます。
| グレーティング結合干渉法(GCI) | 表面プラズモン共鳴(SPR) | バイオレイヤー干渉法(BLI) | |
|---|---|---|---|
| 幅広いアプリケーション範囲 低分子量から高分子量、精製、粗化合物まで、さまざまな分子に適しています。 |
はい フラグメント、小分子、ペプチド、タンパク質、ウイルス、細胞培養上清、血清、細胞ライセートに適しています。 |
いいえ 小分子、ペプチドに適しています(フラグメント、ウイルス、細胞培養上清、血清、細胞ライセートへの適合性は制限されています) |
いいえ 細胞培養上清、血清、細胞ライセートに適しています(ペプチド、タンパク質、ウイルスへの適合性は制限されています) |
| 最も弱い結合能を測定 高速な流体と高い取得率により、高速オフレートでのカイネティクス測定が可能です。 |
はい オフレートkd=10 s-1まで |
いいえ オフレートkd=1 s-1まで |
いいえ オフレートkd=0.1 s-1まで |
| 最も強い結合能を測定 高速オンレートでも、正確にカイネティクスを測定する、強い結合能を測定します。 |
はい フロー条件で測定 |
はい フロー条件で測定 |
いいえ 拡散が制限された条件下での測定(マイクロ流体なし) |
| 少ないシステムのメンテナンス サービスや想定外の修理によるダウンタイムがほとんどありません。 |
はい 非凝固マイクロ流体 |
いいえ 従来のマイクロ流体 |
はい マイクロ流体なし |
分子相互作用は、エバネッセント場(オレンジ)内の屈折率の変化によって検出され、導波管内のビームの位相シフトが発生し、画面に平行に投影された参照ビームへの干渉が発生します。

WAVEsystem創薬およびライフサイエンス向けの次世代バイオ解析装置で、産業研究と学術研究の両方に対応 |
|
|---|---|
| グレーティング結合干渉法(GCI) | |
| ラベルフリー検出 |