生物膜干涉法 (BLI)、表面電漿共振法 (SPR) 與光柵耦合干涉法 (GCI) 之比較

生物膜干涉法 (BLI) 是一種光學測量、以表面為基礎、免標記的技術。與其他生物感測器技術不同,BLI 不適用於微流體流動,而是將感測器的尖端浸入樣品/緩衝液中。從光纖尖端反射的光會移相,移相程度取決於尖端表面附近的折射率。反射光與從內部參考表面反射的光會互相干涉。
透過使用白光當成光源,記錄下光譜干涉圖案,其中包含尖端表面附近折射率的相關資訊。當生物分子與浸在實驗溶液 (例如樣品) 中的生物膜表面相結合時,折射率分布和光譜圖案會發生變化。
表面電漿共振法 (SPR) 是另一種光學、免標記分析方法 – 事實上,它是最早的以表面為基礎的無標記技術之一。SPR 檢測的是感測器表面附近漸逝場內分子相互作用所引起的折射率變化。
在這些感測器中,玻璃支架上的金屬薄膜被特定波長的光照射。在特定照射角度下,根據接近表面的折射率,所謂的表面電漿子會被激發。由於反射光束中缺少能量,因此在投射到感測器上時,強度會「下降」。
透過即時判定下降的位置,SPR 可以測量金屬表面折射率的變化。使用微通道注入含有分析物的溶液,並使用至少一個參考流通槽,來消除體積效應。
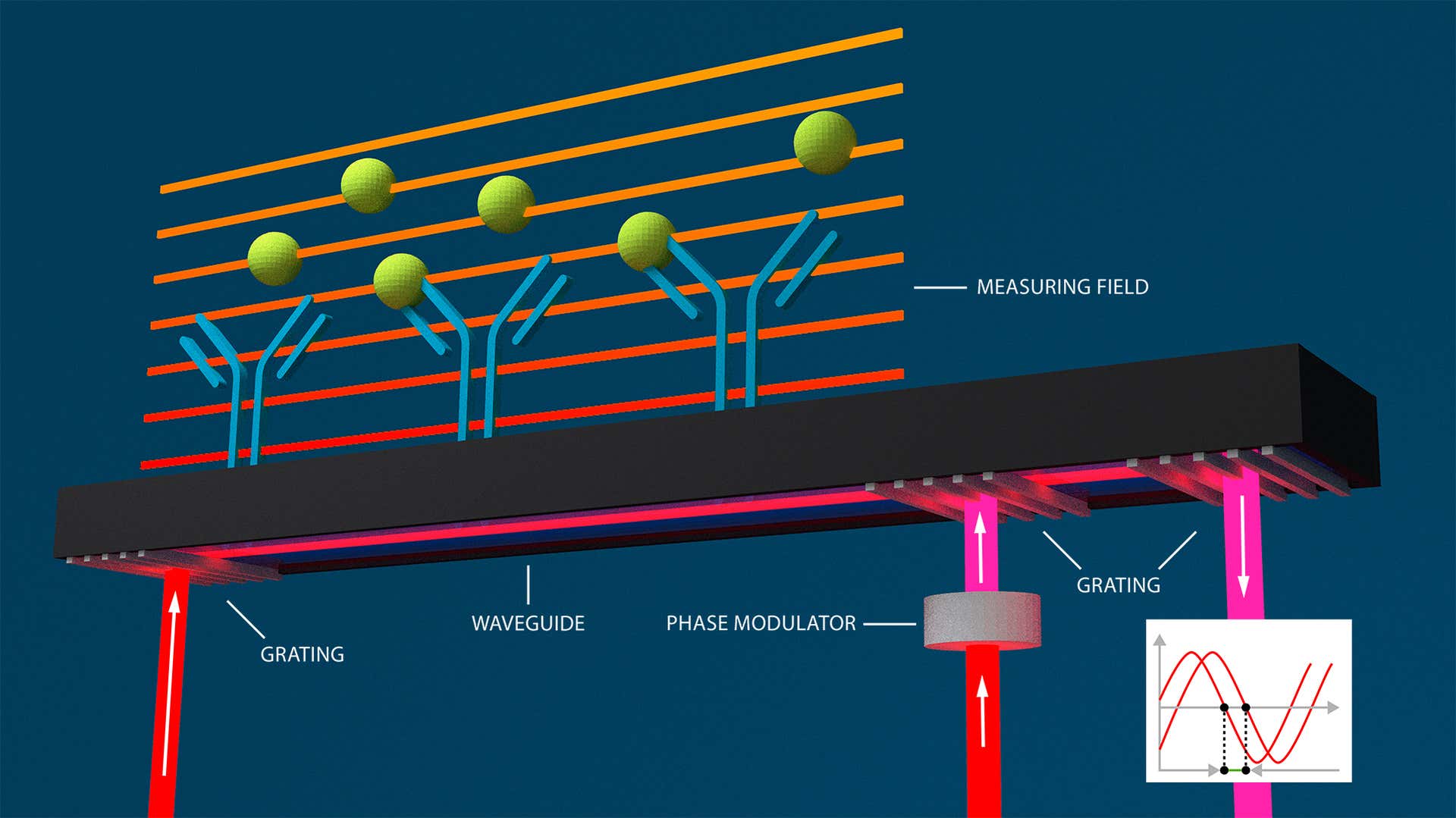
以波導干涉法為基礎 (另一種光學免標記方法),光柵耦合干涉測量法 (GCI) 可以即時監測並將分子相互作用表徵化,判定動力學速率參數、親和力常數,以及會與固定配體起相互作用的分析物分子之濃度。
在波導干涉法中,折射率的變化是在感測器表面附近的波導漸逝場內測量。這些變化也會導致光相位發生變化。光穿過波導,產生橫跨感測器表面全長的漸逝波。相位變化以干涉方式顯示。Creoptix 的 GCI 技術,利用了波導干涉測量的優勢,並消除典型的對準問題:
![[GCI_CX_weblandscape.jpg] GCI_CX_weblandscape.jpg](https://dam.malvernpanalytical.com/b266ecf3-637f-41d5-a36a-ae29010df43c/GCI_CX_weblandscape_Original%20file.jpg)
最佳生物分子相互作用技術,將取決於應用和使用者的目標。以下您可看到這三種技術根據四個關鍵要求進行比較:應用範圍廣泛、測量最弱結合對、測量最緊密結合對,以及低系統維護要求。
| 光柵耦合干涉法 (GCI) | 表面電漿共振法 (SPR) | 生物膜干涉法 (BLI) | |
|---|---|---|---|
| 最廣泛的應用範圍 適用於各式分子,包括從低至高分子量的純化或原始分子。 | 是 適合片段、小分子、胜肽、蛋白質、病毒、細胞培養上澄液、血清、細胞溶解產物 | 否 適合小分子、胜肽 (對於片段、病毒、細胞培養上澄液、血清、細胞溶解產物的適用程度則有限) | 否 適合細胞培養上清液、血清、細胞溶解產物 (對於胜肽、蛋白質、病毒的適用程度則有限) |
| 測量最微弱的黏合劑 多虧快速流動率和高取樣率,因此能夠測量快速解離率的動力學。 | 是 解離率最高達 kd=10 s-1 | 否 解離率最高達 kd=1 s-1 | 否 解離率最高達 kd=0.1 s-1 |
| 測量最緊密的黏合劑 即使是緊密的黏合劑和快速的締合率,仍能準確測量動力學數據。 | 是 在流動條件下進行測量 | 是 在流動條件下進行測量 | 否 在擴散受限條件下測量 (無微射流) |
| 低系統維護需求 很少因為保養或非預期的維修而造成停機。 | 是 No-clog 微流道 | 否 傳統微流道 | 是 無微流道 |