溶液中の生体分子間相互作用の機能とメカニズムを分子レベルで理解するため、結合親和性と熱力学的パラメータを蛍光標識、または固定化などによる結合パートナーの修飾を必要とせず、天然状態に近い環境下でダイレクトに測定します。
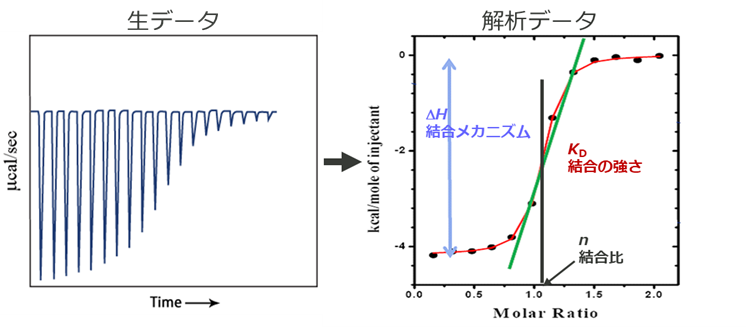
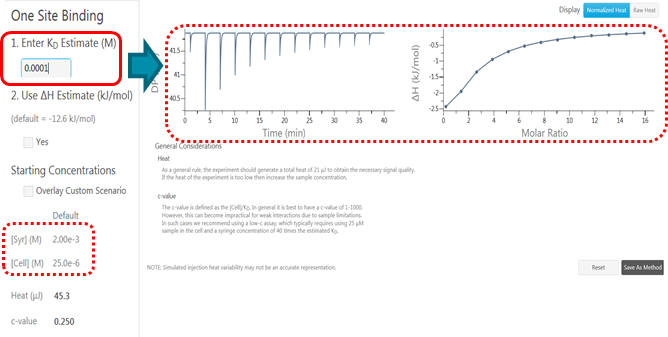
分子は相互作用するときに結合様式に応じた発熱、または吸熱反応が起こります。ITCではこの熱変化をダイレクト、かつノンラベルで測定します。得られた熱量変化から、解離定数(KD)、化学量論(結合比)(n)の他に、エンタルピー変化(∆H)およびエントロピー変化(ΔS)などの熱力学的パラメータも求められます。 これにより分子間相互作用の完全な熱力学的プロファイルが得られます。このように構造と機能の関係についての理解を深めることで、創薬開発におけるヒット化合物の選定とリード化合物の最適化を、より自信を持って意思決定を下すことができます。
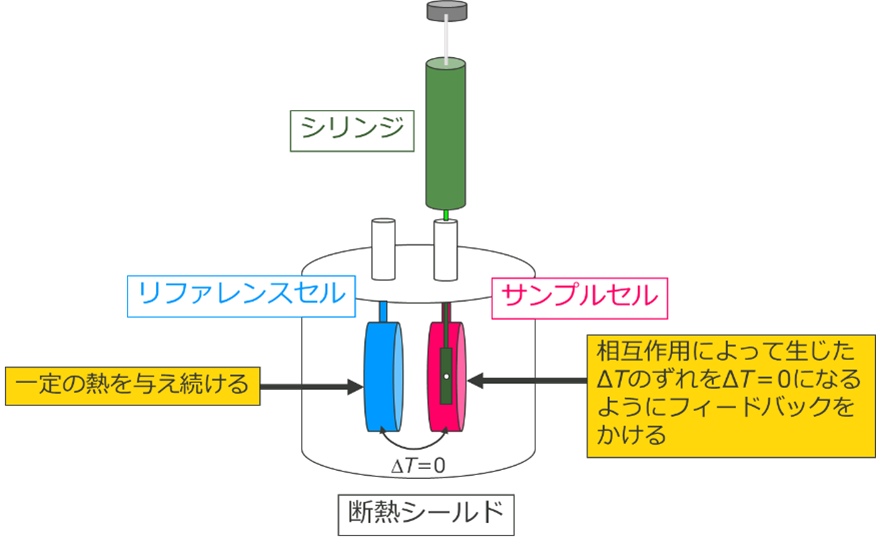
ITCのサーマルコアには2つのセルがあり、そのうちの一方には水を充填し、リファレンスセルとして機能し、もう一方にはサンプルを充填します。 サンプルセルに撹拌シリンジを挿入して、相互作用する分子(リガンド)を少量ずつ滴下すると発熱または吸熱が起こります。このときに生じるリファレンスセルとサンプルセルとの温度差を限りなくゼロにするために加えられたセルヒーターのディファレンシャルパワー(DP)を測定することにより、これらの熱変化 をモニターします。
ITCの測定原理および測定方法の詳細はこちらをご参照ください。
ITCは溶液中での分子間相互作用に伴って生じた熱量変化をダイレクトに検出することで、結合親和性と熱力学的パラメータを評価できる唯一の測定技術です。タンパク質に異なる複数の結合サイトがあるような場合でも、ITCはそれぞれの結合部位に対するパラメータの定量が可能です。また、分子量の制限がありませんので、金属イオンのような小さい分子であっても測定が可能です。

相互作用解析を実施する測定技術としては、 ELISA(酵素結合免疫吸着法)、SPR(表面プラズモン共鳴法)、MST(マイクロスケール熱泳動法)など多岐にわたります。(詳細についてはこちらをご参照ください。)
ELISAでは、相互作用で複合体を形成した分子の片方に対し結合する標識抗体の蛍光・化学発光を検出する間接的な方法であったり、SPRでは片方の分子を基板上に固定化しているため完全な溶液中でのフリーな状態での測定ではありません。その他ITCでは、mMレベルからnMレベルまでの幅広いKD範囲をカバーすると共に、詳細な結合様式の区別、化学量論(結合比)の算出といった、その他の相互作用解析では取得困難なパラメータも求められます。
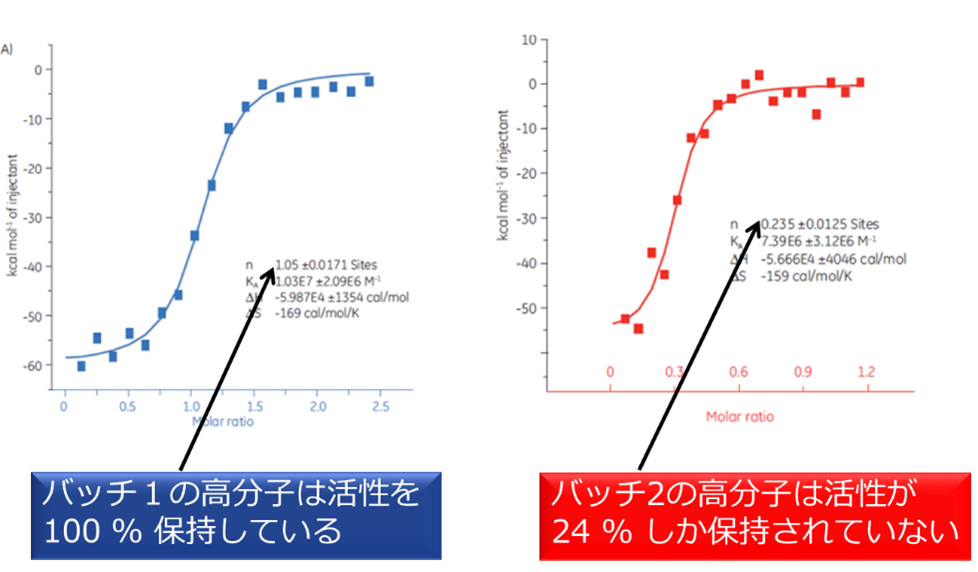
これらの情報は、創薬開発における薬剤の詳細な機能評価に活用され、例えば単に結合(=作用)しやすいだけでなく、どのように結合しているのか(=特異的、非特異的)を知ることもできます。また、近年は高分子医薬品(抗体医薬品など)の品質を知る重要性も出てきており、すでに知られている化学量論と計測上との違いから、溶液中の高分子医薬品の品質把握にも用いられています。
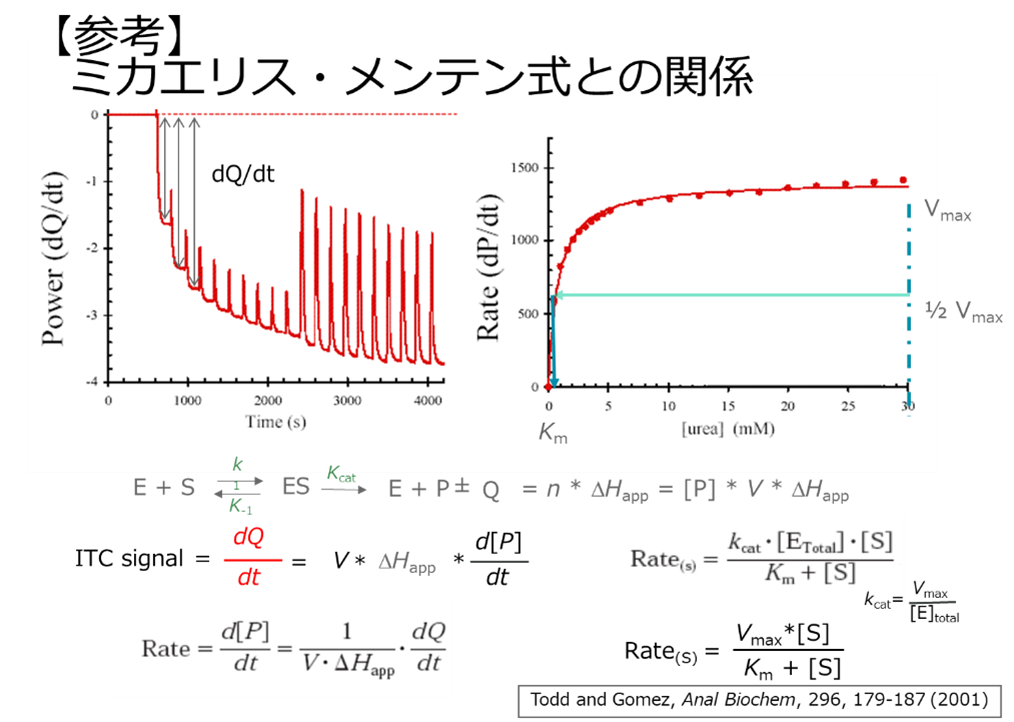
さらに、創薬開発のターゲットである酵素活性評価では、ミカエリス・メンテンのメカニズムを有する酵素反応のKmおよびKcatをITCで求めることができます。一般的な酵素活性測定は標識試薬を用いることが多いですが、ITCでは酵素と基質(±阻害剤)の反応を熱量変化として検出するため、 標識が不要で、溶液中でより自然に近い測定条件下、且つリアルタイムで酵素反応をモニターできます。また、温度が制御された環境下で測定されるため、高い精度、および再現性を有しています。
どちらの装置もMicroCal PEAQ-ITCソフトウェアによって操作します。このソフトウェアには、以下の特徴がございます。

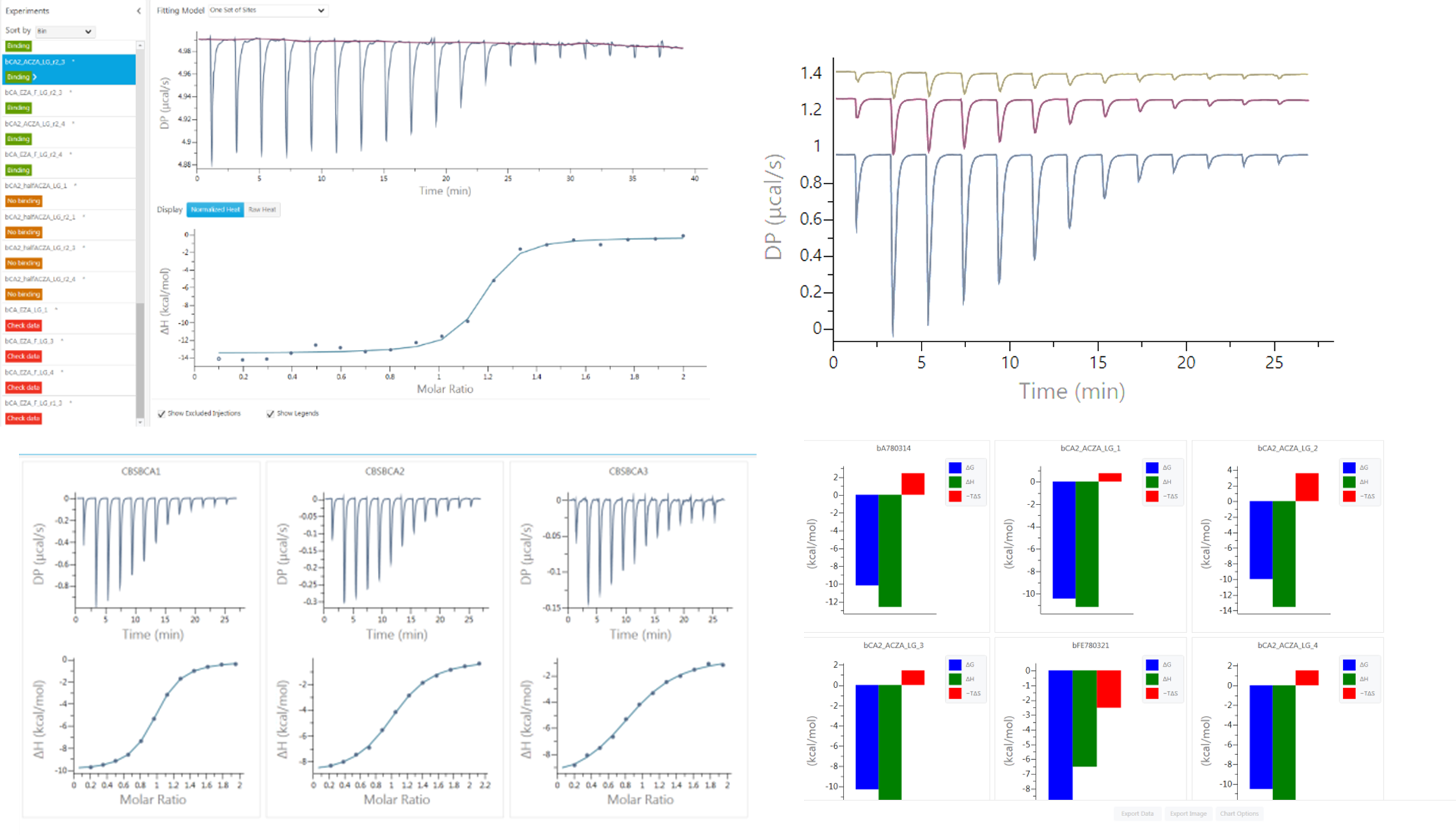
―FBDDにおけるMalvern MicroCal Auto-iTC200の多様なアプリケーション
― Studying low-affinity fragments of ligands by ITC

PEAQ-ITCすべての結合パラメータを高感度で測定。 |

MicroCal PEAQ-ITC Automated結合に関する様々なパラメータを高い生産性で測定可能 |
|
|---|---|---|
| 測定タイプ | ||
| ラベルフリー解析 | ||
| 結合親和性 | ||
| 技術 | ||
| 等温滴定型カロリメトリー(ITC) | ||
| サンプル処理 | ||