このアプリケーションノートでは、サンプルの消費量を抑えながらスループットを高めたMalvern MicroCal iTC200が、アッセイ開発からリード分子最適化に至るワークフローでどのように使用されているかについて説明します。
創薬研究のゴールは治療面で有益な反応を引き出せるように、ターゲットの活性を変化させることです。 薬は一般的に、結合し、生理学的なターゲットの活性が変化したときにのみ効果が出ます。 そのため、創薬の初期段階では、薬物候補となるターゲットの親和性と選択性の最適化にフォーカスしています。
等温滴定型カロリメトリー(ITC)は、低分子とタンパク質間の相互作用における熱力学的な結合パラメータを測定するために使用されています。 解離定数(KD)、結合比(n)、自由エネルギー変化(ΔG)、エンタルピー変化(ΔH)、ならびにエントロピー変化(ΔS)を同時に測定することで、創薬プロセスのさまざまな段階における重要な情報を入手できます。
次の例では、MicroCal iTC200システムで測定した詳細な結合情報が、創薬の各段階でどのように寄与しているかについて示しています。
ある研究では、アッセイ開発時に標的タンパク質に結合しているペプチドを評価する必要があります。 ここでのゴールはターゲットタンパク質と、将来、薬となりうる成分との結合メカニズムの理解を深めることです。 また、測定結果、特に結合比(n)と親和性(KD)は、それ以降のターゲットタンパク質製剤の品質と活性を評価するために使用できます。
2つ目のアプリケーションではITCを、1次スクリーニング後のターゲットタンパク質に対するヒットバインダーを調べるためのオルトゴナル法として使用しています。 生化学アッセイデータやその他の生物物理学的手法(表面プラズモン共鳴(SPR)や核磁気共鳴(NMR)など)とITCデータを組み合わせて得られたポジティブな結果は、真のヒットと擬陽性を正しく識別するのに役立ちます。
最終的な段階では、リード分子の最適化段階における化合物を対象に、自由エネルギーのエンタルピーおよびエントロピーの寄与を調べます。 結合親和性(KD)、結合比(n)、自由エネルギー変化(ΔG)、エンタルピー変化(ΔH)、エントロピー変化(ΔS)を同時に測定することで、リード化合物の開発を促進する重要な情報を入手できます。 結合エネルギーに対するエンタルピーおよびエントロピーの寄与は、医薬品候補がターゲットとどのようにインタラクトするかについての手がかりとなる情報を提供します。 この情報は構造活性相関を構築し、コンピューターを使ったドラッグデザインに使用することができます。
ITCは、こうした有用かつ詳細な情報を1回の実験で提供することができますが、これまでの方法ではタンパク質および化合物の使用量が多いため、創薬で広く使われているわけではありませんでした。 MicroCal iTC200の導入は、この問題を解決しました。 MicroCal iTC200では、従来のITCシステムに比べ、サンプル消費を1/7に抑え、測定時間も2~4倍短縮できるため、高いスループットを実現できます。
タンパク質、ペプチド、低分子化合物はHoffmann La-Rocheの社内で調製しました。 MicroCal iTC200装置はMalvern社から入手可能です。 測定温度は25℃で実施しました。
全ての緩衝液は測定前に脱気を実施しました。 30µM Bcl-2を50 mMのHEPES、pH7.4、100 mMのNaCl、0.5 mM TCEP、5%DMSOに溶かしたものをサンプルセルに充填しました。 同じ緩衝液でペプチドを250 µMに希釈しました。 3 µlを6秒かけて滴定し、間隔は150秒にセットしました。 データの解析には、MicroCal対応のOrigin™ソフトウェア(OriginLabs社)を使用しました。
|
ITCデータ、特に結合比(n)と解離定数(KD)を使用し、タンパク製剤の品質を評価しました。
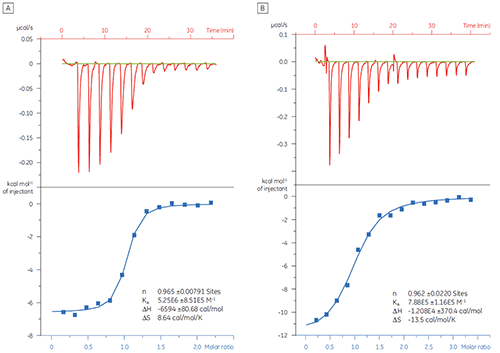
この例では、ターゲットタンパク質Bcl-2(B細胞リンパ腫2)に対する2つの異なるペプチドの相互作用をMicroCal iTC200で測定しました。 結果は図1に示しています。 Bcl-2タンパク質に対するBAD様(Bcl-2-associated death promoter)ペプチドの結合は、BAX(Bcl-2-associated X protein)ペプチドよりも約6倍の強さを持っています。
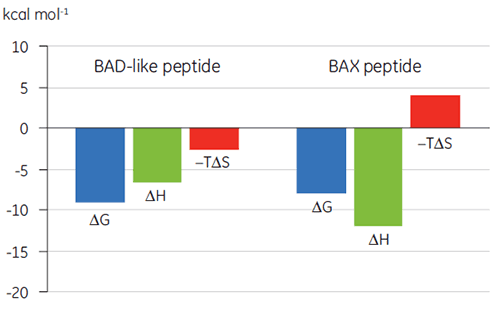
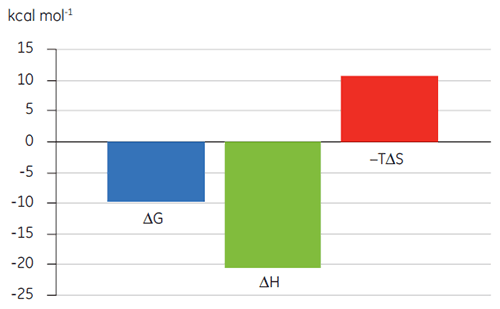
結合様式プロット(図2)で熱力学パラメータを視覚化すると、エンタルピーおよびエントロピーが全体的な親和性(ここではΔG)にどのように寄与するかを簡単に確認できます。 このプロットでは、BAD様ペプチドとBcl-2の結合は、ネガティブまたは結合に有利なエンタルピー変化(ΔH)およびエントロピー変化(TΔS)であることから、極性相互作用と疎水性相互作用で構成されていることを示唆しています。 BAXの結合の場合は、エントロピー的に不利であることから、よりコンホメーション変化が伴っていることを示唆しています。
|
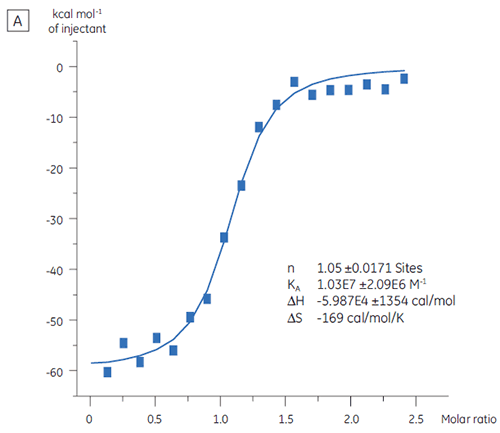
ITCはターゲットタンパク質の結合活性レベルの評価を、スクリーニングにかける前に実施することができます。 この実験では、2つの異なるバッチのターゲットタンパク質間の比較を、タンパク質に対し97 nMのアフィニティを持つ陽性コントロールペプチドを滴定することで実施しました。
|
|
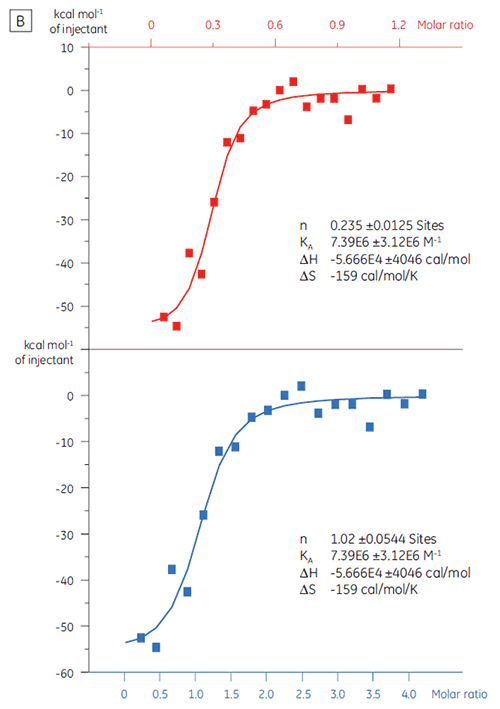
ターゲットタンパク質 バッチ A(図3 A)は、KDは、97 nMでn = 1で期待通りでした。これは完全に活性化を保持しているタンパク質であることを示唆しています。 ターゲットタンパク質 バッチB(図3B)のKDは135 nMでしたが、nはわずか0.23です。これは、一部のみが活性を有しているタンパク質であることを示唆しています。 タンパク質濃度を10 µMではなく2.3 µMでバッチBのデータを解析すると、KD値は変わりませんが、n = 1になります。 このことは、バッチ Bのタンパク質の75%が非活性であったことを示しています。 結果、バッチ Bのタンパク質は、
スクリーニングで使用されませんでした。
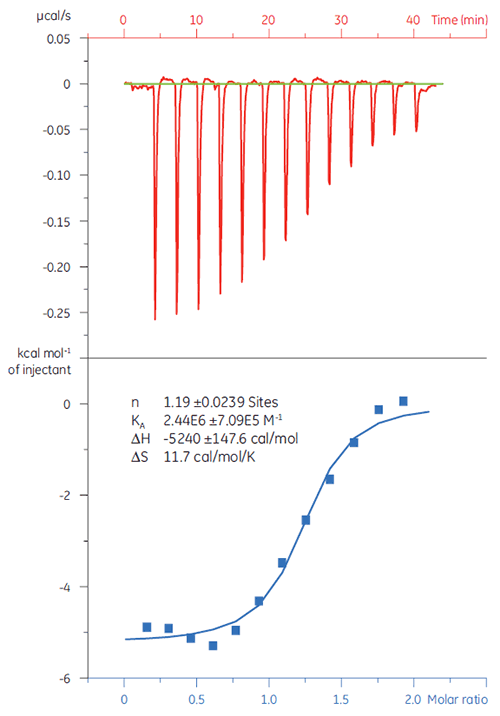
スクリーニング初期段階で擬陽性排除することが重要です。 20 µMのターゲットタンパク質(TP)にCompound Xを滴定しました(図4)。 その結果、KD(1/KAの逆数)は4.9 µMでした。これは、SPRおよびNMRの測定結果と非常によく相関していたため、Compound Xは正しいヒット化合物であり、以降の測定に適していることが確認できました。
|
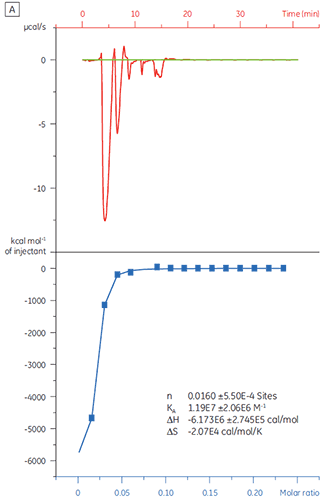
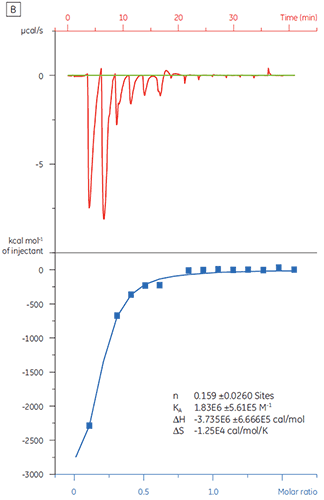
同じターゲットタンパク質にCompound Yを滴定すると、結果は大きく異なるものになりました(図5)。 Aのデータは、Compound YをTPで滴定したものです。 等温滴定曲線から120 nMの解離定数を得られましたが、結合エンタルピーは予測値よりもおよそ1000倍大きく、結合比の値は極めて低いものでした(n = 0.01)。 BのデータはCompound Yをウシ血清アルブミン(BSA)に滴定したものです。 これらをまとめると、この結果は非特異的な活性であることを示しています。 以上の結果に基づき、Compund Yは擬陽性とみなされ、以降の測定から除外されました。
|
|
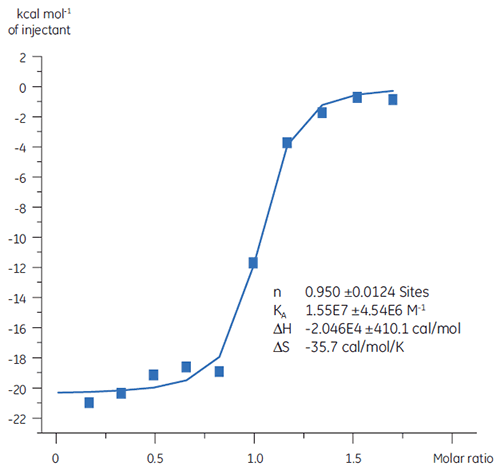
以前の測定で、Compound AとTPの結合は、25 nMのKDが示唆されていました。 この相互作用の熱力学的特性評価をさらに進めるために、ITC実験を行いました(図6)。 100 µM Compound Aを10 µTPに滴定すると、KD値は65 nMになりました。 結合様式プロット(図7)ではエンタルピー相互作用によって親和性が促進されたものの、エントロピー的には不利になっていることがわかります。
エンタルピー相互作用は通常、水素結合とファンデルワールス相互作用によって促されますが、結合に有利なエントロピーは疎水性相互作用から生じます。 不利なエントロピーは、この例と同じように、複合体に対する相互作用様式の自由度が低下しているために起こります。 これは2つの分子が相互作用する場合に常に見られる現象ですが、この影響の大きさは、タンパク質がコンホメーション変化を経たか、またはリガンドがきわめて柔軟であることを示唆しています。 このエントロピー的に不利な状況を減少させる、明確な最適化の筋道を、ITCで見出すことができます。
これまでの経験から、エンタルピーを最適化することは結合エントロピーを最適化することよりも難しく、これらのパラメータのいずれかを使用して親和性を最適化することに依存しすぎると、薬物動態学的特性に問題がある(親水性または疎水性が高すぎる)化合物ができる可能性もあります。 つまり、エンタルピー駆動のリードから始め、その後にエントロピーを向上させるために「操作」する方が得策と言えるでしょう。
|
|
MicroCal iTC200を用いて、ITCを創薬ワークフローに取り入れました。これにより、次のことが明らかになりました。
これらのデータはDr.Lin Gao(Hoffman-La Roche、ニュージャージー州ナットレー)の厚意により提供していただきました。