
MicroCal ITC Produktlinie
Bestimmung der Bindungsparameter von Biomolekülen in einer einzigen Analyse
Markierungsfreie Messung der Bindungsaffinität und Thermodynamik biomolekularer Wechselwirkungen zur Aufklärung von Funktion und Mechanismen auf molekularer Ebene
Die Isothermale Titrationskalorimetrie (ITC) ist ein markerfreies Quantifizierungs-Verfahren, das bei Untersuchungen verschiedenster biomolekularer Wechselwirkungen eingesetzt wird. Es basiert auf der direkten Messung der Wärme, die bei einem biomolekularen Bindungsereignis entweder abgegeben oder aufgenommen wird.

Bestimmung der Bindungsparameter von Biomolekülen in einer einzigen Analyse
Die ITC ist das einzige Verfahren, mit dem alle Bindungsparameter in einem einzigen Experiment simultan bestimmt werden können. Es erfordert keine Modifikation der Bindungspartner, weder mit Fluoreszenzmarkern noch durch Immobilisierung. Die ITC misst die Affinität von Bindungspartnern in ihrem nativen Zustand.
Die Messung der Wärmeübertragung während der Bindung ermöglicht die genaue Bestimmung der Bindungskonstanten (KD), der Reaktionsstöchiometrie (n), der Enthalpie (∆H) und der Entropie (ΔS). Diese Werte liefern ein komplettes thermodynamisches Profil der molekularen Wechselwirkung. Über die Bindungsaffinitäten hinaus kann die ITC die Mechanismen aufklären, die den molekularen Wechselwirkungen zugrunde liegen. Dieses tiefere Verständnis der Struktur-Funktions-Zusammenhänge ermöglicht fundiertere Entscheidungen bei der Hitauswahl und Leitstrukturoptimierung.
Die Isothermale Titrationskalorimetrie wird zur Untersuchung von Reaktionen zwischen Biomolekülen verwendet. Das Verfahren ermöglicht die Bestimmung der Bindungsaffinität, der Stöchiometrie und der Entropie und Enthalpie der Bindungsreaktion in Lösung, ohne dass Markierungen benötigt werden.
Wenn die Bindung erfolgt, wird Wärme entweder aufgenommen oder abgegeben. Dieser Vorgang wird durch das empfindliche Kalorimeter während der stufenweisen Titration des Liganden in die Probenzelle gemessen, die das zu untersuchende Biomolekül enthält.

Das Mikrokalorimeter verfügt über zwei Zellen, von denen eine Wasser enthält und als Referenzzelle dient und die andere die Probe enthält. Das Mikrokalorimeter muss diese beiden Zellen auf exakt gleicher Temperatur halten. Wenn die Bindung erfolgt, erkennen die Temperatursensoren einen Temperaturunterschied zwischen den Zellen. Dieser Messwert wird als Steuergröße an die Heizung geführt, um den Unterschied zu kompensieren und die Zellen wieder auf gleiche Temperatur einzustellen.
Referenzzelle und Probenzelle werden auf die gewünschte Experimenttemperatur eingestellt. Der Ligand wird in eine Spritze geladen, die sich in einer sehr genauen Injektionsvorrichtung befindet. Die Injektionsvorrichtung wird in die Probenzelle eingeführt, die das zu untersuchende Protein enthält. Nun wird in die Proteinlösung eine Reihe kleiner Aliquoten des Liganden injiziert. Wenn eine Bindung des Liganden an das Protein erfolgt, werden Temperaturschwankungen von wenigen millionstel Grad Celsius erkannt und gemessen.
Ab der ersten Injektion misst das Mikrokalorimeter die gesamte abgegebene Wärme, bis die Bindungsreaktion das Gleichgewicht erreicht hat. Die gemessene Wärmemenge ist direkt proportional zum Bindungsgrad.
Im folgenden Beispiel ist die Reaktion exotherm, d. h., die Probenzelle wird wärmer als die Referenzzelle, wodurch das Signal einen Peak nach unten aufweist. Wenn die Temperatur der beiden Zellen wieder gleich ist, kehrt das Signal in seine Ausgangsposition zurück. Das zweite kleine Aliquot des Liganden wird in die Probenzelle injiziert, und erneut kompensiert das Mikrokalorimeter die geringe detektierte Wärmemengenänderung.
Das molare Verhältnis zwischen Ligand und Protein wird durch eine Reihe von Ligandeninjektionen schrittweise erhöht. Das Protein wird immer mehr gesättigt, sodass weniger Bindungen des Liganden erfolgen und die Wärmemengenänderungen beginnen, abzunehmen, bis die Probenzelle schließlich einen Überschuss des Liganden gegenüber dem Protein enthält und die Reaktion in die Sättigung geht.

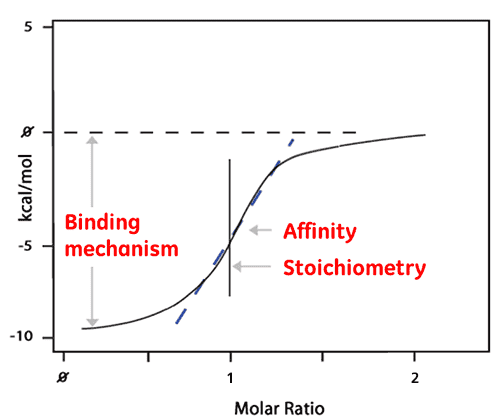
Die einzelnen Peakflächen werden anschließend integriert und gegenüber dem molaren Verhältnis zwischen Ligand und Protein aufgetragen. Die resultierende Isotherme kann an ein Bindungsmodell angepasst werden, von dem die Affinität (KD) abgeleitet wird. Das molare Verhältnis im Zentrum der Bindungsisotherme gibt die Reaktionsstöchiometrie an. Das unten gezeigte Diagramm ist ein Beispiel einer 1:1 Bindungsreaktion.
Die Enthalpie (ΔH) kann ebenfalls direkt aus der Isotherme abgeleitet werden. Sie entspricht der abgegebenen Wärmemenge pro Mol des gebundenen Liganden. Somit liefert ein einziges ITC-Experiment eine Fülle von Informationen über die Bindungsreaktion und hilft damit, die Art der Wechselwirkung und die thermodynamischen Ursachen zu verstehen.
Die ITC wird in der Erforschung und Entwicklung von Arzneimitteln weithin für folgende Zwecke eingesetzt:

PEAQ-ITCHochempfindliche Messung aller Bindungsparameter. |

MicroCal PEAQ-ITC AutomatedHochproduktive Messung mehrerer Bindungsparameter. |
|
|---|---|---|
| Typ der Messung | ||
| Markierungsfreie Analyse | ||
| Bindungsaffinität | ||
| Technologie | ||
| Isotherme Titrationskalorimetrie (ITC) | ||
| Probendurchsatz | ||