Hochdurchsatz-Screening in der Arzneimittelforschung
Nach der Identifizierung eines Zielproteins (z. B. eines Proteins, das mit einer bestimmten Krankheit assoziiert ist und in Genuntersuchungen identifiziert wurde) besteht der nächste Schritt darin, ein Medikament für dieses Protein zu finden (d. h. eine Verbindung, die in vivo in das Zielprotein eingreift und die Krankheit heilt oder lindert). Diese Phase der Arzneimittelforschung erstreckt sich in der Regel über 6-10 Jahre.
Bei dieser Art der Arzneimittelforschung geht es darum, aus Tausenden potenzieller Verbindungen ein finales Medikament für ein Ziel zu identifizieren. Dabei versucht man zunächst, aus einer Bibliothek von Hunderten bis Tausenden von Verbindungen vielversprechende Verbindungen zu identifizieren, die mit dem Ziel interagieren (Treffer). Die Bindungswechselwirkung dieser Treffer, die oft die Bindungskinetik umfasst, wird dann geprüft und die Verbindung gegebenenfalls zu einer Leitstruktur (Lead) weiterentwickelt. Der letzte Schritt besteht darin, die Leitstruktur zu einem Medikament zu entwickeln, indem man Eigenschaften wie Stabilität, Löslichkeit oder Bindung verbessert.
Das Hochdurchsatz-Screening (HTS) ist der experimentelle Workflow, bei dem eine große Anzahl von Verbindungen (halb-)automatisiert auf bestimmte Merkmale untersucht wird. In den Frühphasen der Arzneimittelentwicklung wird HTS häufig zur Trefferidentifikation eingesetzt, zum Beispiel, um eine Bibliothek kleiner Moleküle auf ihre Wechselwirkung mit einem Medikamentenziel zu untersuchen. Es gibt keine feste Definition dafür, wie viele Verbindungen gescreent werden müssen, damit das Verfahren als Hochdurchsatz eingestuft wird. In der Regel wird jedoch ein Bereich von bis zu mehreren Tausend Verbindungen untersucht.
Das Hochdurchsatz-Screening von Wirkstoffen sollte die Zahl der weiter zu verfolgenden Verbindungen erheblich reduzieren, muss aber auch qualitativ hochwertige Treffer ermitteln (Vermeidung von falsch-positiven und falsch-negativen Ergebnissen). Das Bestätigen von Treffern und deren Entwicklung zu Leads ist zeitaufwändig und teuer. Forschende wollen also nicht zu viele Treffer erzielen, aber auch keine potenziellen Arzneimittel übersehen, indem sie das HTS zu eng fassen.
Der Arbeitsablauf für die frühe Wirkstoffidentifizierung lässt sich auf verschiedenen Ebenen automatisieren: HTS in der Arzneimittelentwicklung kann von der Probenvorbereitung mit Geräten zur Flüssigkeitshandhabung über die Messung selbst bis hin zur Analyse und zum Export der Ergebnisse eingesetzt werden.
Geräte zur Flüssigkeitshandhabung übernehmen die für die Probenvorbereitung erforderliche Pipettierarbeit (z. B. Transfer, Verdünnung, Zusätze und Inkubation). Die Proben werden in der Regel in einer Mikrotiterplatte (96-Well oder ein Vielfaches davon) vorbereitet und dann an das Gerät übertragen, das die Messung durchführt und beobachtet (z. B. Messung der Bindungskinetik der Verbindungsbibliothek zum Ziel).
Je nach Maßstab und Anwendung erfolgt der Plattentransfer zwischen Geräten durch Roboter oder manuell. Mehrere Messungen können nacheinander von einem oder mehreren Geräten durchgeführt werden. Zum Schluss müssen die aus den Messungen erzeugten Daten analysiert und wahrscheinlich exportiert und in Berichte gefasst werden.
Das WAVEsystem, das auf der Technik der GCI (Gitter-gekoppelten Interferometrie) beruht, kann kinetische Bindungsdaten während der Frühphasen der Arzneimittelentwicklung liefern. Diese kinetischen Daten – für die Assoziations- (ka) und die Dissoziationsrate(kd) – liefern mehr Informationen als die Affinitätsdaten allein, da Wechselwirkungen mit derselben Affinität eine sehr unterschiedliche Kinetik aufweisen können. Die frühzeitige Gewinnung von Daten über die kinetische Bindung (und nicht nur über die Affinität) ermöglicht eine bessere Auswahl der Treffer, an denen man die Forschung fortsetzen möchte.
Mit der proprietären waveRAPID®-Methode können diese kinetischen Daten schneller abgerufen werden als mit anderen Methoden, wodurch der Durchsatz erhöht und kinetisches Screening ermöglicht wird. Der tatsächliche Durchsatz hängt von der Anwendung ab: Beispielsweise benötigt die Messung kleiner Moleküle mit schneller Kinetik in der Regel weniger Zeit als die Messung langsamerer Wechselwirkungen, die typischerweise bei Antikörpern zu finden sind.
Darüber hinaus ermöglicht waveRAPID® die Messung der Bindungskinetik aus einem einzigen Well, wodurch ein Teil der Probenvorbereitung (die Verdünnungsreihe) entfällt.
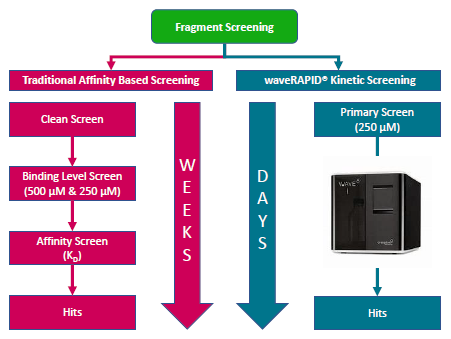
Herkömmlicher affinitätsbasierter Screening-Ablauf parallel zum kinetischen Screening-Ablauf mit waveRAPID®. Der waveRAPID®-Ablauf umfasst das WAVEdelta-System, das ein einfaches und zeitsparendes Screening von Fragmenten ermöglicht.

HTS ist der Schlüssel zur Beschleunigung Ihrer Arzneimittelentwicklung. Die Qualität der im HTS generierten Daten, die als Entscheidungsgrundlage dafür dienen, mit welchen Treffern die Forschung fortgesetzt werden soll, bestimmt den Erfolg Ihres Prozesses.
Bei der Durchführung von HTS ist sowohl die Vermeidung von falsch-positiven als auch der Ausschluss von falsch-negativen Ergebnissen entscheidend: Die Menge der Verbindungen, die HTS für die weitere Entwicklung identifiziert hat, wirkt sich auf den Aufwand aus, der für die Entwicklung der Medikamente erforderlich ist. Frühzeitig erhaltene Daten zur Bindungskinetik und nicht nur zur Affinität liefern Ihnen bessere Entscheidungsgrundlagen für die Identifizierung und Weiterentwicklung dieser Treffer.

WAVEsystemBioanalytische Instrumente der nächsten Generation für die Arzneimittelforschung und Biowissenschaften sowohl für die Industrie als auch die akademische Forschung |
|
|---|---|