Sichere Charakterisierung der Proteinstabilität
Die dynamische Differenzkalorimetrie (DSC) ist ein Analyseverfahren, mit dem die Stabilität eines Proteins oder eines anderen Biomoleküls direkt in seiner nativen Form ermittelt werden kann. Dabei wird die Wärmemengenänderung gemessen, die mit der thermischen Denaturierung des Moleküls einhergeht, wenn dieses mit einer konstanten Rate erwärmt wird.
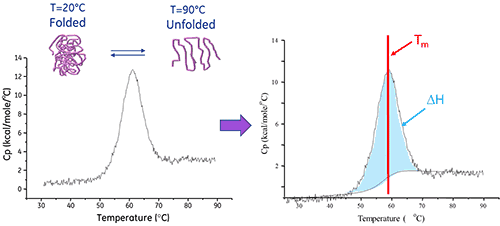
Ein Biomolekül in Lösung befindet sich im Gleichgewicht zwischen seiner nativen (gefalteten) und denaturierten (ungefalteten) Konformation. Je höher der Mittelpunkt des thermischen Übergangs (Tm) liegt, umso stabiler ist das Molekül. Mittels DSC wird die Enthalpie (∆H) der Entfaltung gemessen, die aus der hitzeinduzierten Denaturierung resultiert. Mit diesem Verfahren kann auch die Änderung der Wärmekapazität (ΔCp) der Denaturierung bestimmt werden. Mithilfe der DSC können die Faktoren erkannt werden, die zur Faltung und Stabilität nativer Biomoleküle beitragen. Zu diesen gehören hydrophobe Wechselwirkungen, Wasserstoffbrücken, konformationelle Entropie und die physikalische Umgebung.
Die mittels DSC erhaltenen, genauen und qualitativ hochwertigen Daten liefern wichtige Informationen zur Proteinstabilität in der Prozessentwicklung sowie zur Formulierung potenzieller therapeutischer Kandidaten.
Makromoleküle und makromolekulare Komplexe (> 5000 Dalton), wie Proteine, Nukleinsäuren und Lipide, können ganz bestimmte definierte Strukturen ausbilden, die thermisch induzierten, konformationellen Änderungen unterliegen. Diese strukturellen Umlagerungen bewirken eine Wärmeaufnahme infolge der Umverteilung nichtkovalenter Bindungen. Diese Wärmeaufnahme kann mit Differential Scanning Calorimetry gemessen werden.
Ein DDK-System verfügt über eine thermische Messkammer mit zwei Zellen, einer Referenz- und einer Probenzelle.
Das Gerät ist so konzipiert, dass die beiden Zellen beim Erwärmen auf gleicher Temperatur gehalten werden.
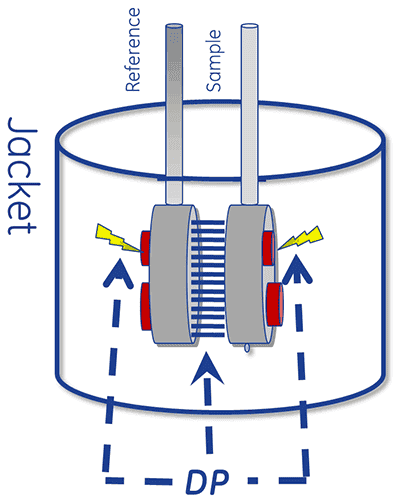
Um eine DDK-Messung durchzuführen, werden zuerst die Referenzzelle mit einer Pufferlösung und die Probenzelle mit der Probenlösung befüllt. Die Zellen werden dann mit einer konstanten Durchlaufrate erwärmt.
Die bei der Proteinentfaltung auftretende Wärmeaufnahme bewirkt einen Temperaturunterschied (ΔT) zwischen den Zellen und damit ein Temperaturgefälle zwischen den beiden Seiten der Peltier-Elemente. Dadurch wird eine Spannung aufgebaut, die in Leistung umgewandelt und zur Steuerung des Peltier-Elements verwendet wird, um ΔT (die Temperaturdifferenz) auf 0 °C zurückzusetzen. Alternativ können die Zellen durch Leitung passiv ein thermisches Gleichgewicht erreichen.
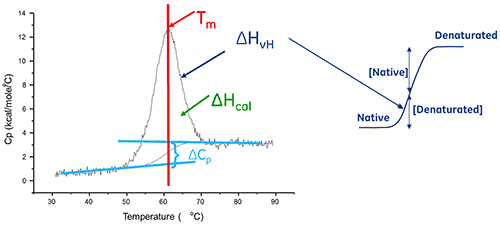
Die Enthalpie der Proteinentfaltung entspricht der Fläche unter dem konzentrationsnormalisierten DDK-Peak. Sie wird in Kalorien (bzw. Joule) pro Mol gemessen.
In bestimmten Fällen können die Daten an thermodynamische Modelle angepasst werden, um die mit dem Übergang verbundenen Werte der Gibbs-Energie (ΔG), der kalorimetrischen Enthalpie (ΔHcal), der Van-'t-Hoff-Enthalpie (ΔHvH), der Entropie (ΔS) und der Änderung der Wärmekapazität (ΔCp) zu erhalten.
Die differenzielle Kalorimetrie-Analyse wird häufig für die Arzneimittelforschung und -Entwicklung eingesetzt. Zu den typischen Anwendungen gehören:

MicroCal PEAQ-DSC AutomatedHochwertige Proteinstabilitätsanalysen im regulierten Umfeld |

MicroCal PEAQ-DSCHochwertige Analysen der Proteinstabilität für Forschungsanwendungen |
|
|---|---|---|
| Typ der Messung | ||
| Markierungsfreie Analyse | ||
| Proteinstabilität | ||
| Technologie | ||
| Dynamische Differenzkalorimetrie (DDK) | ||
| Probendurchsatz | ||
| Probendurchsatz | x pro 24 Std. Tag - 50 pro 24 Std. Tag | x pro 8 Std. Tag - 6 pro 8 Std. Tag |
| Temperaturbereich | ||