タンパク質複合体溶液の調合で起こりうるさまざまな相互作用の1つとして、タンパク質-添加剤の結合があります。このアプリケーションノートでは、その結合の特性評価をITCとDSCでどのように行ったかについて説明しました。
Biopharmaceutical Technologies, GlaxoSmithKline R&D, 709 Swedeland Rd,
King of Prussia, PA 19406 (USA)
タンパク質は本来不安定な性質を備えており、物理的な不安定性(アンフォールディング、凝集、吸着)および化学的劣化(酸化、脱アミド、分解)として現れる可能性があるため、タンパク質ベースの治療薬の開発はチャレンジングなタスクです。 こうした不安定性により、タンパク質の活性が低下したり、免疫原性種が生成されたりする可能性があります。 タンパク質安定化の1つのアプローチとして、接している溶媒の性質を変化させる、というものがあります。これを実現するには、緩衝液の選定、pHの調節、添加剤/添加剤の追加(最適な製剤を作り出すための)などを注意深く選定する必要があります。
タンパク製剤の溶媒ベースの安定化で重要な1つの要素は適切な添加剤の選定です。同様に、添加剤の濃度の最適化も保管期間を延長しながら患者への安全性を最大限にするために重要です。 このように、タンパク製剤開発で重要なのは適切な溶解性をもち、毒性がなく、タンパク質の構造的完全性維持し、容認できる保管期間を可能にし、製剤の生物学的活性を保持している添加剤の選択です。 これらの添加剤には、アミノ酸、塩、金属、界面活性剤、糖、ポリオール、ポリマーなどがあります。 これらは安定化剤、界面活性剤、抗菌剤または抗酸化剤などの役割を果たします。 安定化効果は通常、タンパク質特有のもので、濃度に依存しています。
添加剤の選択に加え、最適な添加剤濃度や、さまざまな製剤成分の間の相互作用に関する情報を収集する必要があります。 各添加剤の選択と濃度の最適化は、大規模な製剤スクリーニングと安定性試験を伴い、大きな労力を要する作業となる可能性があります。 安定化の一般的な指針は過去10年の文献から明らかになってきたものですが(1)、添加剤が保管時にタンパク質の安定性を向上させるメカニズムはまだ完全に明らかにはなっていません。 添加剤とタンパク質との相互作用のメカニズムを把握していれば、経験主義的なスクリーニング手法から離れ、タンパク質製剤の合理的な設計と最適化を行うことができます。そのため、タンパク質製品開発の時間と材料必要量が縮小されます。 また、タンパク質と添加剤の相互作用の強さと種類に関する情報は、タンパク質医薬品の生体内における挙動を予測する上で役立ちます。
生物物理学的解析手法は、製剤開発の添加剤スクリーニングできわめて役立つことが実証されています。 特に、カロリメトリーはタンパク質の安定性と相互作用を評価する最も効率的な手法です。これは、すべての事象が可逆的な場合、システムの完全な熱力学的特性評価を実行できるためです。 タンパク質と添加剤の相互作用を調べる熱量測定法は、バイオ医薬品製剤の設計と最適化にますます採用されています。 カロリメトリーは、会合、解離、アンフォールディングプロセスによる熱変化を測定することで、高分子相互作用のエネルギー論と化学量論を判定するという原理に基づいています。 ITCは、等温状態における結合親和性、解離定数、結合比、エンタルピー、エントロピー、ギブズ自由エネルギーなどの熱力学的パラメータを判定するために主に使用されます。 また、幅広い温度で実験を行うことで結合の際の熱容量変化の特定にも使用できます。 DSCデータは、変性中点温度、エンタルピー、エントロピー、ギブス自由エネルギー、熱容量変化を含む、タンパク質のアンフォールディングに関わる熱力学パラメータを提供します。
これらの熱力学パラメータは通常、異なる製剤でのタンパク質の安定性を比較したり、特定の添加剤の相対的な安定化および不安定化効果を判定したりする場合に使用します。
このアプリケーションノートでは、添加剤とタンパク質の相互作用を理解できるようにし、カロリメトリーがProXの製剤開発をどのように支援したかについて例を示します。 ProXの製剤緩衝液への添加剤として、ここではポリソルベート80とフェノールについて調べました。 ポリソルベート80は、タンパク質の非特異的吸着および凝集を防ぐために一般的に使用されている界面活性剤で、タンパク質と相互作用することが知られています(2, 3)。 ポリソルベート80は、タンパク質分子表面に露出した疎水性領域に結合することで、表面に誘起された凝集からタンパク質を防ぎます(3)。 最もよく使われているポリソルベート80の濃度は0.002~0.1%(w/v)です。 フェノールは、同じ容器から複数回投与する製剤用の抗菌剤として使用されます。 フェノールは毒性があるため、製剤緩衝液で使用する濃度は最低限に抑える必要があります。 最も広く使われている濃度は0.3~0.5%(v/v)です。
MicroCal VP-Capillary DSCを使用して実験を行いました。 各サンプル400 µLおよび該当する緩衝液を96ウェルプレートにセットしました。 測定温度範囲は25°~100°C、スキャンレート60°C/hでスキャンし、各スキャンの前には15分間の平衡時間を置きました。 タンパク質スキャンから緩衝液スキャンデータを差し引きし、濃度によるノーマライズを実施後、DSC用Originソフトウェアでデータを解析しました。
MicroCal iTC200を使用して実験を行いました。 サンプルセルには10または25 mg/mLのProXを250 µL充填し、滴定シリンジには60 mMのフェノールまたは50 mMのポリソルベート80を40 µL、ProXと同じ緩衝液に溶かして充填しました。 リファレンスセルには、脱イオン水を充填しました。 いずれの実験でも、サンプルセルに0.2~2 µLずつ、トータル40 µLを0.5 µL/秒の速度で滴定しました。 測定設定は、撹拌速度1000 rpm、リファレンスパワー5~8 μCal/秒、フィードバックモード/ゲイン設定は高、温度25°C、イニシャルディレイは60秒です。 コントロール実験として、緩衝液に緩衝液の滴定、滴定サンプルの希釈、ProXの希釈をそれぞれの実験から差し引きしました。 データはITC用Originで解析しました。 ITC測定でサンプルを使用する前に、0.2 μmタンパク質低吸着シリンジフィルタ(Pall Life Sciences製)でサンプルにフィルターをかけ、シリンジとセルで緩衝液ミスマッチが起こらないようにするため、添加剤溶液の調製に使用しているものと同じ緩衝液で各タンパク質サンプルを透析しました。
医薬品の活性成分に添加剤を直接結合すると、複数の経路で製品が影響を受ける可能性があります。 最近の研究で、医薬品製剤で一般的に使用されている添加剤が、活性医薬品の薬物動態学に影響する可能性があることが明らかになっています(4, 5)。 添加剤は、タンパク質医薬品の構造または生体利用効率を改変し、効能を変える可能性もあります。 活性成分の薬物動態または効能が変化する可能性に加え、添加剤/タンパク質の相互作用も保管期間または医薬品の安全性に影響する可能性があります。 そのため、製剤添加剤とタンパク質の相互作用を認識し、理解する必要があります。 タンパク質と溶液添加剤の間に直接的な相互作用が認められた場合、タンパク製剤の調剤をデザインするにあたり、2つの重要な特性について考慮する必要があります。まず1つ目は、タンパク質に結合している添加剤の結合の強さと可逆性です。この添加剤は医療投与後、タンパク質表面の重要な活性部位を妨げるか、完全に覆う必要があります。2つ目に重要なことは、非結合添加剤の濃度です。この濃度は目的の溶液特性を得るために十分である必要があります。 ProXを例に、これらの側面について下記に示します。
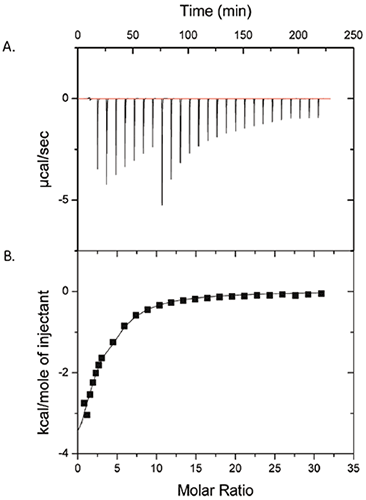
図1は、ITCの測定結果です。この実験では、50 mMのポリソルベート80を25 mg/mLのProXに滴下しました。 (A)測定生データ (B)コントロールデータを差し引き後、滴下サンプル1molあたりに換算した熱量 (B)のデータは、ポリソルベート80とProXの間に測定可能な相互作用があることを示しています。 データは1:1結合モデルでフィッティングを行いました。結合親和性(KA)は1430 ± 260 M-1、結合のエンタルピー変化(ΔH)は-6.3 ± 1.1 kcal/mol、ProX分子1つあたりのポリソルベート80の結合比(n)は2.6 ± 0.3でした。 結合のエントロピー変化(ΔS)は-6.7 ± 3.7 cal/mol-Kでした。
|
等温滴定曲線に基づき、ProXのポリソルベート80結合部位は、ProXの1分子あたり10個のポリソルベート80のモル比で飽和したと結論づけられました。 ポリソルベート80の臨界ミセル濃度(cmc)は、純水で0.012 mMです。また、タンパク質溶液では0.1 mMの高さであると報告されています(2)。 図1のITC実験では、ポリソルベート80の濃度は0.1~7 mMで、最初の滴下後でもcmcを上回っています。 この情報は重要です。タンパク質と界面活性剤で検出可能な相互作用は、界面活性剤がモノマーではなくミセルに起因していることになります。
製薬開発において、結合パラメータの知識は、添加剤がタンパク質に「飽和」した状態で結合し、安定化を達成するのに必要な最低限の濃度を決めるのに役立ちます。 製剤における添加剤の濃度を最低限に抑えると、患者に投与される添加剤の濃度に加え、コストも削減できます。 この事例では、タンパク質の1分子ごとにポリソルベート80が10倍の過剰量となり、この量がポリソルベート80がタンパク質を飽和させるために十分でした。 タンパク質-添加剤複合体の生体内の挙動を予測するために、結合パラメータを使用することもできます。したがって、ITCで測定した弱い結合定数は、ProX/ポリソルベート80複合体が血流に入ったときに希釈され、複合体が解離し、添加剤のタンパク質医薬品の生物学的活性に対する影響はなくなることを示唆しています。
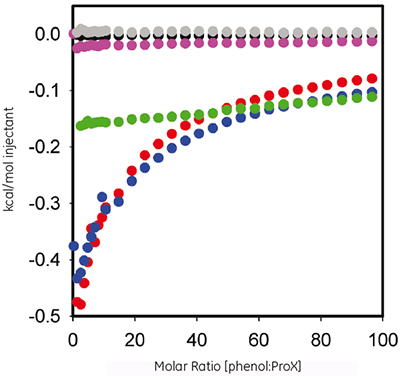
フェノールは、ProX製剤の抗菌剤として使用されます。 タンパク質と保存料の間の測定可能な結合のサーモダイナミクスを評価するために、ここではITCを使用しました。 図2は、pH 5.7、4.5、3.5それぞれのpH条件で、60 mMのフェノールを10 mg/mLのProXに滴定したときのプロット。コントロール実験を差し引き後、横軸にモル比、縦軸に滴定ごとの熱量をプロットしました。
|
ITCデータは、pH 5.7とpH 4.5で、ProXがフェノールと相互作用していることを示しています。しかしながらpH3.5では結合していませんでした。 得られた等温滴定曲線は、既存の結合モデルのいずれにも適合しませんでした。これは、結合様式が複雑で、複数の結合サイトをもつことを示しています。
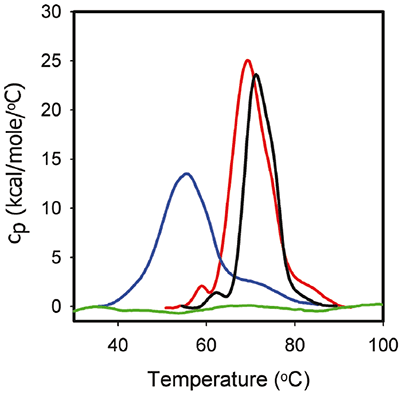
図3は、ITC実験で使用されるものと同じ、製剤緩衝液内の1 mg/mL ProXのDSCデータです。 フェノールが含まれないpH5.7のProX(赤)では、少なくとも3つの 変性中点温度が存在しました。Tm1、Tm2、Tm3はそれぞれ59℃、68℃、85℃でした。このとき中央の転移はメインのアンフォールディングイベントになります。 アンフォールディングの合計エンタルピー変化(ΔH<1>unf</1>)は270 kcal/molでした。 pH 4.5(青)では、最初の転移は検出不可能でした。 メインアンフォールディングイベントはTm2は55°Cになり、Tm3は73°Cに低下しました。 また、ΔHunfは216 kcal/molに低下しました。これは、3次相互作用の強度が低下していることを示唆しています。 最後に、pH 3.5では、DSCで検出可能なアンフォールディング転移が存在しておらず、これはProXが酸でアンフォールドされたことを示しています。
|
図3は、pH 5.7でフェノールが存在している場合のProXアンフォールディングのDSCサーモグラム(黒)も示しています。 フェノールを添加することによりTm1を1°C、Tm2を2°C、フェノール不含のときよりも上げ、ΔHunfを195 kcal/molに低下させました。 しかしながら、ProXの3次構造は、蛍光などを用いた他の生物物理的な特性評価データでは、フェノールが存在している場合も存在していない場合も同じでした(データは未掲載)。 一般的に、DSCの挙動変化は、他の手法での構造変化に相関させることができます。しかしながら、これは常に当てはまるわけではありません。 DSCの変化は、天然タンパク質構造を安定化させる力(ファンデルワールス、疎水性、および静電相互作用、水素結合など)と露出残基を安定化させる水和力が損なわれたことに由来すると考えられています。 3次相互作用の不安定化は、タンパク質のコンパクトさを低下させる可能性がありました。これは、DSCでは検出可能ですが、他の解析手法で検出できる構造変化では引き起こされない現象です。
ITCとDSCのデータ組み合わせにより、フェノールとタンパク質の相互作用に関する重要な情報が明らかになりました。 (1)フェノールはフォールドされたProXに結合しますが、アンフォールドしたProXに結合しません(図2)。したがって、ProXがフェノールの結合部位を維持するためには、3次構造を保持しておく必要があります。 (2)タンパク質の3次構造を機能させるためには、pH 5.7が最適なpHと思われます。 (3)図2で見られるように、フェノールとProXに結合させると、50を超えるモル比で完全に飽和します。 (4)計算したフェノール:ProXのモル比38(完全飽和に近いものの、まだ不完全飽和)で、DSC測定(1 mg/mLのProXを0.005%(v/v)フェノールを含むpH 5.7の製剤緩衝液調製)を実施しました。 (5)結合部位は飽和していなかったものの、このフェノールのモル比は、ProXの熱安定性を向上させるのに十分な値でした。
ProXが存在している場合、フェノールの抗菌活性は低下することが明らかになりました(データは未記載)。 この知見と、フェノールがProXに結合するという知識を統合すると、結合したフェノールは、未結合フェノールと比較して抗菌活性がないか低いという結果になります。 結合曲線に従い、飽和結合ポイントを超えるフェノールの濃度を製剤用に選択されました。この濃度であれば、未結合フェノールは効果的な抗菌活性を発揮できるレベルになります。 当初、フェノールが存在している場合のProXのTm値の上昇は予測されませんでした。しかしながら、この結果はフェノールによる熱安定性の向上を示しているため、タンパク質の長期的な安定性は向上するものと考えられます。 ですが、フェノールによる安定化とフェノールの抗菌効果の間に、直接的な相関を確認することはできていません。
ITCとDSCを使用し、フォールドされたProXにフェノールをpH 5.7で結合することと、ポリソルベート80がProXに結合することを確認し、それを熱力学的に特性評価しました。 ProXとポリソルベート80の結合定数の測定値によれば、この相互作用は弱いと見なされます。そのため、生体内で製剤中の安定化添加剤が活性タンパク質から解離するため、タンパク質医薬品の完全な生物学的効果が、添加剤で阻害されるという影響が最低限に抑えられると予測できました。 最適な抗菌機能とより高い熱安定性を備えた製剤を作るために、ProX-フェノール滴定の飽和曲線に基づいて、飽和ポイントを上回るフェノールの濃度を識別されました。 仮説上の添加剤結合が裏付けられただけではなく、これら2つの添加剤の最適な濃度(cmcよりも高い濃度でProXの1分子あたり10倍のポリソルベート80の過剰モル、およびProXの1分子あたり50倍のフェノールの過剰モル濃度)が特定されました。
タンパク質製剤の必須条件には、安全性と有効性があります。 安全かつ有効なタンパク質治療薬を作り出すために、添加剤を追加し、生成物の安定性を強化して保管期間を延長するには、タンパク質と添加剤の間の相互作用を分子レベルで理解する必要があります。 タンパク質複合体溶液の調合で起こりうるさまざまな相互作用の1つとして、タンパク質-添加剤の結合があります。このアプリケーションノートでは、その結合の特性評価をITCとDSCでどのように行ったかについて説明しました。
Arakawa, T., et al, Factors affecting short-term and long-term stabilities of proteins. Adv. Drug Deliv. Rev. 46, 307-326 (2001).
Chou, D. K., et al, Effects of Tween 20 and Tween 80 on the stability of Albutropin during agitation. J. Pharm. Sci. 94, 1368-1381 (2005).
Bam, N. B., et al, Tween protects recombinant human growth hormone against agitation-induced damage via hydrophobic interactions J. Pharm. Sci. 87, 1554-1559 (1998).
Ren, X., et al, Pharmaceutical excipients inhibit cytochrome P450 activity in cell free systems and after systemic administration. Eur. Jour. Pharm. Biopharm. 70, 279-288 (2008).
Taheri-Kafrani, A., et al, T. Beta-lactoglobulin structure and retinol binding changes in presence of anionic and neutral detergents. J. Agric. Food Chem. 56, 7528-7534 (2008).