ここでは、示差操作型カロリメトリー(DSC)がタンパク質特性評価の初期段階において、液体製剤開発のサポートならびに促進をガイドする、タンパク質安定性に関する重要なデータを迅速に提供するために用いられていることを説明します。
モノクロナール抗体開発プロジェクトがさまざまな臨床に適応するために存在しています(1、2)。 モノクローナル抗体を含む商業的に関心の高い組換えタンパク質は、バイオ医薬品の開発を成功させるためにそれ自身がもつ生物学的活性を上回るさらなる特性が必要とされています。 特にそれらは、化学分解に対する耐性をもつとともに、与えられた環境下において凝集することなく、物理的に安定である必要があります。 さらに、至適な血清半減期をもち、免疫原性がない、またはほとんど示さない必要があります。
凍結乾燥製剤は、液体製剤よりも製造にコストがかかるだけでなく、医師が液体製剤に戻す必要があり、患者に非経口投与するまでに10~20分もかかってしまいます。 バイオ医薬品業界が推し進めている、従来の凍結乾燥製剤の代わりになる液体製剤開発として注力しているリソースの主な立役者は簡易投与です。 ただし、液体製剤については、克服すべき技術的な課題がいくつかあります。 主な課題は、物理的安定性を最大限に保ち、化学分解を最小限に抑えることで、液体製剤の状態でタンパク製のバイオ医薬品の安定性が保たれることです。 特に難しいのは、皮下投与用のバイオ医薬品を開発することです。なぜなら、液体製剤は可能な注入量(1.0~1.5 ml)の限界があり、そのため可能な限り高い濃度のタンパク質を含む必要があるからです(6)。
|
このことは、様々なバイオ医薬品に適するよう精密に調整された液体製剤を提供する製剤開発チームにとって、大きなプレッシャーとなります。 組み換えタンパク質、特にモノクロナール抗体の構造と安定性の解析は、きわめて重要な要素であり、バイオ医薬品用の製剤開発にとって必要不可欠な条件です。 構造情報やタンパク質の安定性に関する情報を得るために、さまざまな技術が発展してきました。 DSCは、タンパク質バイオ医薬品の安定性を研究する上でキーとなる物理化学的手法の1つです(7-11)。 DSCを使用すると、標識やアーティファクトなプローブを使うことなくタンパク質の変性を短時間で測定できます。DSCでは、熱安定性の測定および長期安定性の指標を提供し、サンプルが吸収する熱をタンパク質が変性した状態として判定します。
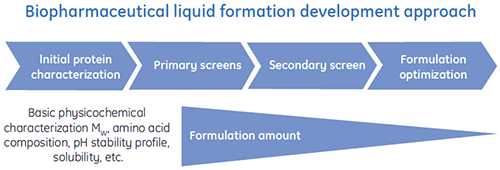
バイオ医薬品向けに、至適化された液体製剤を効率的に提供するための、特別な液体製剤開発プログラムが考案されています。 典型的な液体製剤開発プロセスの一般的なスキームを図1に示しています。
DSCは特に液体製剤開発の初期段階で有用です。この段階では、製剤原料(DS)と複雑な解析に要する時間の節約のために、迅速に溶液条件の数を減らすことが求められています。
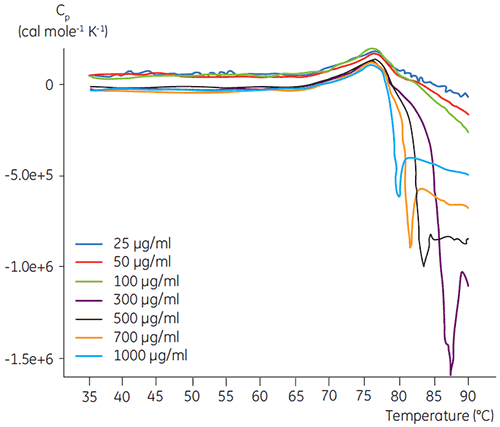
MicroCal VP-DSC(マルバーン社製)を使用し、スキャンレート1.5 K/minでDSC測定を行いました。 サンプルは測定前に5分間、脱気しました。 いずれのサンプルでも、リファレンスセルにはサンプルの緩衝液と同じ緩衝液を充填しました。 タンパク質のスキャンデータから緩衝液のベースラインを差し引きし、モル熱容量に換算したものをデータ解析に使用しました。 すべてのタンパク質で、加熱による変性を確認し、DSCスキャンの加熱と再加熱を比較して可逆性を確認しました(データ未記載)。 その結果、可逆性はありませんでした。 変性温度を得るために、2状態の転移モデルに従って熱量測定プロファイルを解析しました。 抗体濃度100 µg/mlで最適なS/N比のシグナルが得られました(図2)。 濃度が高くなっても変性温度には影響ませんでしたが、変性後のタンパク質の凝集により、高い発熱反応が起こりました。
|
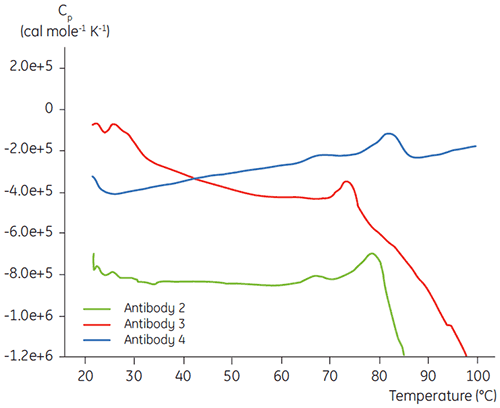
特定の抗体液体製剤開発プログラムの初期段階のタンパク質特性評価において、DSCは、開発中の他の抗体に対する目的の抗体の総合定な安定性を比較するために用いられています。 図3に示すように、複数の異なる抗体の間で変性温度に大きな違いが見られます。
|
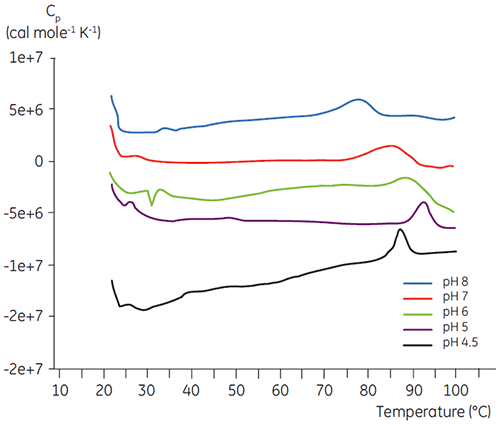
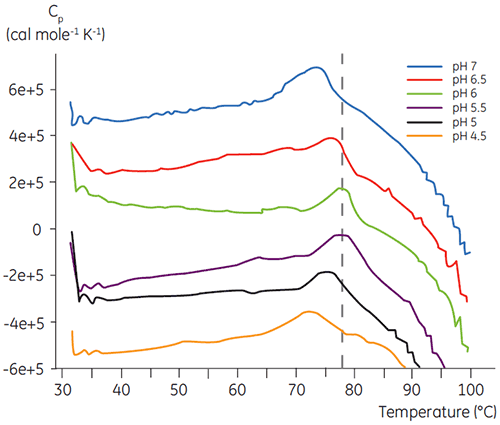
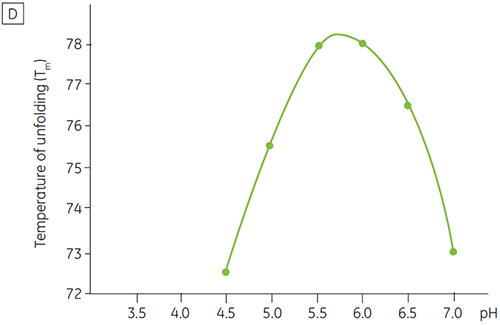
ほとんどのタンパク質と同じように、バイオ医薬品はpHに対して高い感受性を持っているため、安定性を最大限に高めるためには、最適なpHを見つける必要があります。 DSCは、2週間や4週間の加速安定性試験を行わずに情報を得ることができるため、pHを最適化するための効率的なツールとして知られています。 ほとんどの抗体は通常、pH 5.5~6で最も高い安定性を示していますが、例外も見つかっているので、最適なpHを特性評価することも重要です。 図4は融合タンパク質、図5は抗体2のpHプロファイルを表しています。 図からも明らかなように、融合タンパク質(図4)の最適なpHはpH 5で、Tm値は92.8°Cになりました。 融合タンパク質は、pH 5以上になると徐々に不安定化されましたが、低いpHで特に高い感受性を示しました。 pH 4では、変性が見られませんでした(データ未記載)。 図5は、抗体の典型的なpHプロファイルを示しています。 pH 5.5とpH 6で最も高い安定性が得られ、Tm値は78.5°Cになりました。
|
|
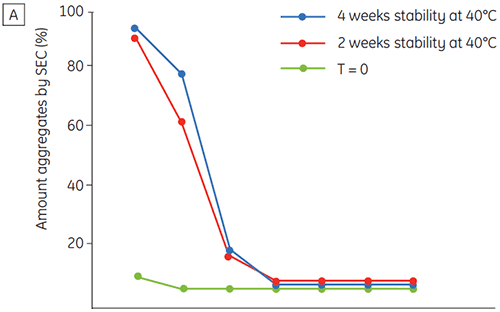
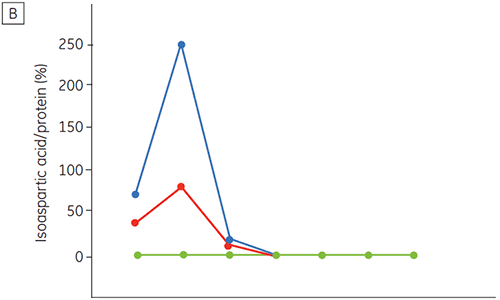
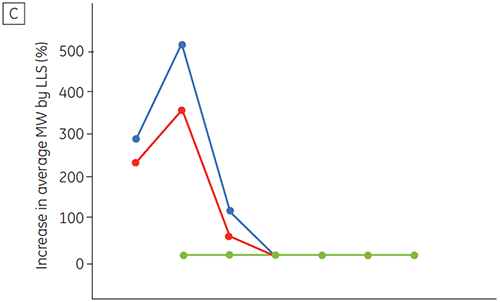
図6は、時間経過およびpHの変化による抗体2の化学的および物理的安定性(初期タンパク質特性評価)を示しています。 pH安定性プロファイル試験では、≤pH 5、40°Cの環境下で抗体2を2週間および4週間、定温放置した結果、安定性が変化しました。 DSCは、フレッシュなサンプル(タイムゼロ)を使用するだけでこのモノクロナール抗体に最適なpH条件を判別できました。これは、他の方法とほぼ同じ結果です(図5)。 さらに、DSCはpH 6.5以上の値を不安定と識別しました。これは、2週間や4週間の時間枠では明らかにならず、判明させるには8~12週間の安定性試験が必要になるものです。 つまり、DSCの結果は、調剤緩衝液の最適なpHを求めるためにこの実験で使用した他の方法と正確に対応しています。
|
|
|
|
DSCの利点は、安定性を特定するためにタイムゼロのサンプルのみを解析すれば済む、ということです。 これは、タンパク質への加熱そのものがストレス誘導的であるためです。 通常、もしタンパク質のネイティブ構造が安定化されれば、熱ストレスに対する耐性は、不安定化したタンパク質と比べてより高くなります。(変性温度がより高くなります) そのため、DSCを使用すると、タンパク質の安定性に対する特定の液体製剤の影響について情報を得るためだけに、さまざまな温度でサンプルの長期安定性をテストする必要はありませんでした。
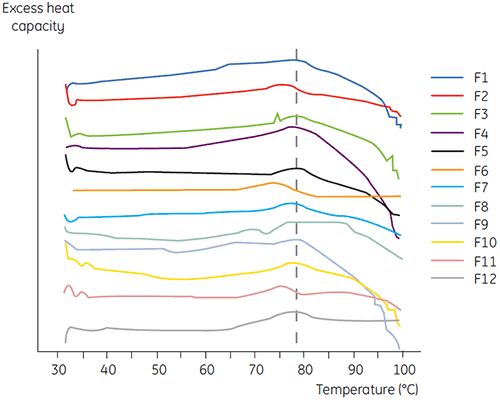
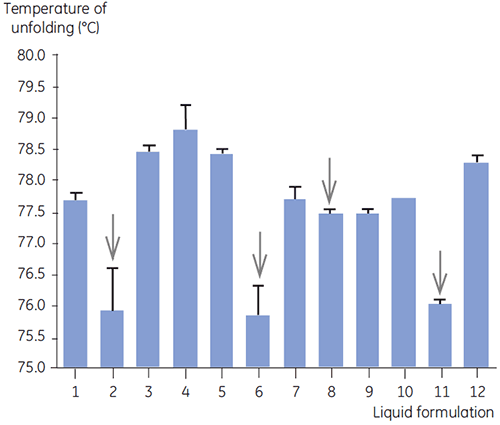
SEC、レーザー光散乱法(LLS)、キャピラリー電気泳動(CE)、SDS-PAGEを含む他の生物物理学的手法と共に、抗体2の1次スクリーニングでDSCを使用し、最も有望な液体製剤を選定しました。 それらのサンプルは加速安定性試験を実施し、4週間後に解析しました 抗体2に悪影響を与えた製剤を識別する上で、DSCが特に役立つことが明らかになりました。また、DSCは良好な液体製剤も選別できました。 DSCは、タイムゼロのサンプルを解析することで、他の解析技術では不適当と見なされた4つの液体製剤(製剤2、6、8、11)を、1次スクリーニングで選出しました。 図7はサーモグラムを表し、図8は1次スクリーングからの液体製剤F1~F12における抗体2の変性中点温度(Tm)を表しています。 製剤F9の抗体2の変性では、明らかに異なる変性パターンが見られました。 そのため、不向きな製剤と判断されました。
|
|
DSCは、タンパク質特性評価と製剤開発の初期フェーズできわめて有効な技術です。 タンパク質安定性に関する重要なデータが速やかに得られ、また、液体製剤開発プロジェクトをサポート、迅速化するためのガイドとして用いることができます。
このアプリケーションノートの著者はDr Fredrik Ollila(Novartis Pharma AG)です。