後発(ジェネリック)医薬品は「先発医薬品と同一または生物学的に同等」であると定義されている1。 ジェネリックは、宣伝をせずに化学名のみで販売されている医薬品にも使われている用語でもある。例えば、特許の有効期限が切れても、製薬会社がその医薬品を後発版として販売しつづけたい場合などである。 米国食品医薬品局(FDA)が承認している後発医薬品は、 先発医薬品と同じ厳格な基準を満たさなければならない。 以下の基準を満たす必要がある。
1984年に、 米国の医薬品の価格競争と特許期間回復法により、後発医薬品の承認のための手順が標準化された。 申請者はFDA医薬品簡略承認申請(ANDA)を提出しすでに承認されている指定された「Reference Listed Drug」に対して実証しなければならない2。 ANDAが承認されると、後発医薬品とReference Listed Drug(先発医薬品)との関係性を示す「オレンジブック」と呼ばれる承認医薬品リストに、FDAがその医薬品を追加する。
後発医薬品が先発医薬品と生物学的に同等であることを示すために、同様の条件で実験を行った場合に同等のバイオアベイラビリティを示すことを実証しなければならない3。 バイオアベイラビリティとは、原薬が医薬品から吸収され、作用点にたどり着く速度と度合いのことで、生物学的同等性とは、2つ以上の医薬品または製剤から同じ製剤原料が同等に放出されることを指す4。
この1984年に施行された法律は、生物学的に同等な医薬品は治療効果も同等であり、したがって交換可能であるということを前提としている。
マルバーンは、二重活性の原薬(API)の先発医薬品と後発医薬品の錠剤のサンプルの分析の依頼を受けた。 目的は、錠剤崩壊後の各APIの粒度分布(PSD)の調査である。粒度分布は、錠剤崩壊後の医薬品のバイオアベイラビリティに大きな影響を及ぼすと考えられるためである。
本アプリケーションノートでは、モフォロギG3-IDで自動画像解析機能とラマン分光分析機能を組み合わせることで、それをどのように製剤中の対象粒子の化学的同定と分離に適用できるかについて述べる。 この化学的同定と分離により、成分の粒度分布も得ることができる。
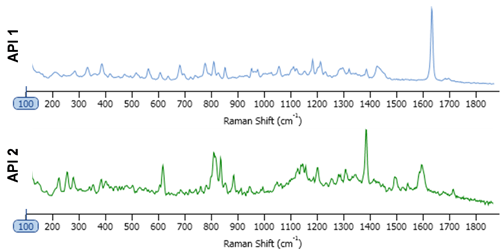
提供された錠剤は、2種類のAPIについて処方量が同じであった。 そのAPIの両方ともが実質的に非水溶性であった。 これらのAPI粒子はほとんど溶解しないという前提で、この錠剤が溶解/崩壊媒体として使用された。 後発医薬品と先発医薬品を各1錠ずつ、100 mlの水に溶かした。 そこから2 mlをサンプリングし、それを20 mlの水で希釈した。 2 mlのサスペンションをアルミニウム膜が施された顕微鏡用スライドにピペットで移し、一晩かけて乾燥させた。 自動画像分析により、粒子径と粒子形状のデータを収集し、分析した。その際の設定は標準操作手順として決め、保存した。 「標準品」成分のスペクトルの一部分から、スペクトル参照ライブラリを作成した(図1)。 この分析では、対象の粒子径範囲を1~10μmとし、ラマンスペクトルをこの粒子径範囲内の粒子からのみ取得した。 粒子スペクトルは、ベースラインのばらつきを最小化するためスペクトル前処理を行い、スペクトル参照ライブラリと相関させた。 粒子のスペクトルとライブラリの要素が類似していればいるほど、相関スコアが1に近くなる。 最終的な粒子の分類は、指定された化学的同一性と粒度分布に基づいて行った。
|
粒子の画像分析結果による形態学的パラメータの分析のみでは、2種類のAPIは区別できなかった。 粒子の形状は類似しすぎていたためである。
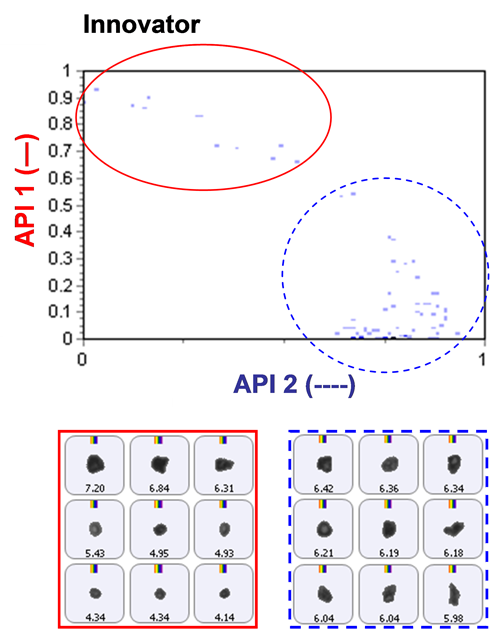
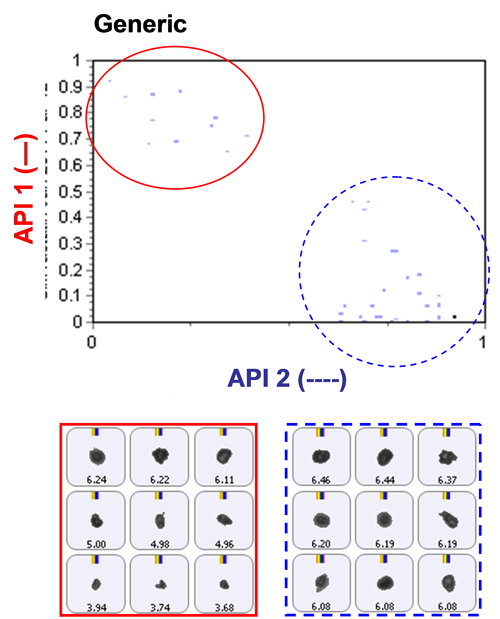
化学的同定のためにラマン分光情報を含めた場合、図2に示すように、2種類のAPIを容易に区別することができた。 このスキャッタグラムは、2種類のAPI成分の相関スコアを対照させてプロットしている。 明らかに、API1とAPI2はラマン分光データにより分離できている。 この図には、粒子画像の例も示している。
|
|
2つのAPIの占有粒子数が区別できると、個別の粒度分布を混合物のデータから特定することができるようになる。
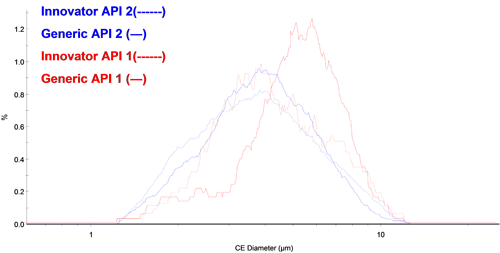
図3に、化学的に定義された粒子数に基づいて、個数基準円相当径(CED)と、各APIの粒度分布の重ねがきを示す。 これにより、後発医薬品に含まれている小さい粒子のAPI1は、先発医薬品のものよりも少ないことが分かる。 API2の粒度分布は、2つの異なる錠剤に対してきれいに重なっている。
|
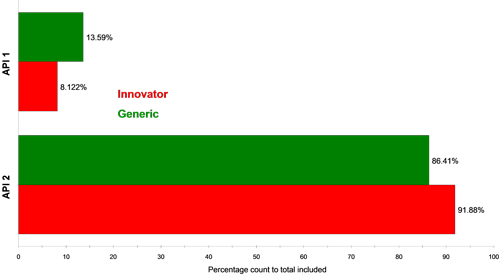
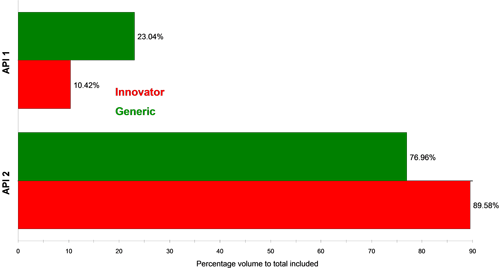
2種類の錠剤に対する2つのAPIのクラス比較チャートを、粒子数と体積をパーセントで表してそれぞれ図4と図5に示す。 各製剤の錠剤は、各APIが同量含まれているが、分析したサンプルについて言えば、先発医薬品にはAPI1よりもAPI2が高い割合で含まれていることが分かる。 こうしたインビトロ法による分析結果とインビボ法によるデータを比較することで、このように観察された違いが後発医薬品の実際のバイオアベイラビリティに影響を及ぼすかどうかということや、後発医薬品と先発医薬品が生物学的に同等かということについての詳細な情報が得られる。
|
|
自動粒子画像分析とラマン分光分析を1つの装置に統合することで、形態学的に指示したラマン分光分析を行うことができる。 これにより、混合物や調合物に含まれる個別の成分を個別に特性評価し、比較することができる。
こうした装置を使用することで、製薬産業での規制対応から問題解決に至る多くの領域にわたって、製品の理解を深めることができるようになる。 しかも、これは製薬だけにとどまらず、ラマンスペクトルを持つその他のサンプルにも適用することができる。