近年、製薬産業では、製剤・製品に関する知識を増やすことを通じて製品の理解を深めようという動きが高まっている。 この目標に対し、混合剤や製剤中に含まれる原薬(API)の粒子径を測定する機能は、製品の効力に関する貴重な知識を提供してきた。こうした知識はコスト節約にもつながることがある。 粒度分布(PSD)は、経口・経鼻吸入剤(ONIDP)の開発と製造において特に重要な特性である。なぜなら、粒度分布は、API粒子が目的地にたどり着き、求められる機能を果たすかどうかを決める主要な決定要因であるからである。 この分析を行う最も一般的な手法は、混合分散剤の中のAPI粒子の手動による顕微鏡観察と視覚的同定によるものである。 しかし、こうした分析には時間がかかるうえ、主観的かつ不正確になることがある。 本アプリケーションノートでは、モフォロギG3-IDの持つ、ラマン分光法と自動画像解析機能を組み合わせることで、どのように乾燥粉末吸入剤(DPI)の中の対象粒子を化学的に同定、分離して、これらの測定の精度と堅牢性を高めることができるかについて述べる。
2種類のAPIから構成された市販のDPIサンプルを、モフォロギG3の乾式試料分散ユニット(SDU)を用いて、アルミニウム蒸着した専用の顕微鏡用スライド上に高圧で乾式分散した。 粒子径と粒子形状は、標準操作手順に従って自動画像解析法により測定した。 この解析では、1~10μmの粒子径範囲を対象としている。 この粒子径範囲に含まれる全粒子を1つの「クラス」としてまとめ、その後、ラマン分光分析を行い、化学的に同定した。 純粋成分のラマンスペクトルの一部分から、スペクトル参照ライブラリを作成した。 このライブラリと粒子スペクトルは、ベースラインのばらつきを最小化するために事前に処理し、ピーク強度の差異が最小になるように正規化した。 その後、粒子のスペクトルをライブラリ内のスペクトルと相関させることで、粒子を化学的に同定した。 粒子のスペクトルとライブラリの要素が類似していればいるほど、相関スコアが1に近くなる。 粒子は特定された化学的同一性に基づいて分類され、得られた占有粒子数に基づいて粒度分布(PSD)が特定される。
自動画像解析の結果だけでは、製剤中の2つのAPIを区別することはできなかった。 統計的に言えば、その2つのAPIの粒子形状は類似していた。
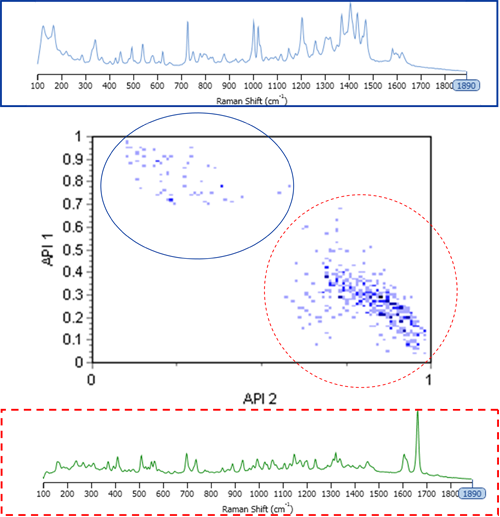
図1に、サンプル中の2つのAPI成分に対する相関スコア結果のスキャッタグラムと、ライブラリの作成に使用した純粋成分のスペクトルを示す。 スキャッタグラムにより、異なる形態的/化学的パラメータ間の関係を調べ、視覚化することができる。 また、スキャッタグラムは統計的情報も提供し、色が濃い部分ほど多くの粒子があることを示す。
|
図1から、化学的情報により2つのAPI粒子数の区別が可能になることが明確に分かる。 したがって、測定結果に適切なクラスを設定することで、混合物から個別の粒度分布を得ることができる場合がある。
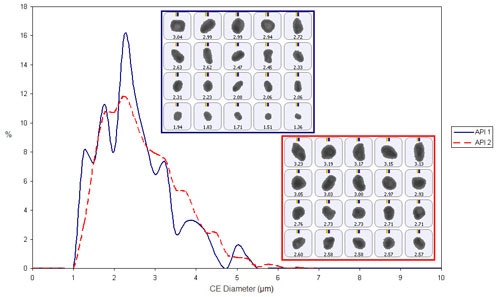
図2に、化学的に定義された粒子数に基づいて、個数基準円相当径(CED)でプロットした場合の、各APIの粒度分布の重ねがきを示す。 分析したサンプル中では、2つのAPI間に大きなばらつきは見られない。
|
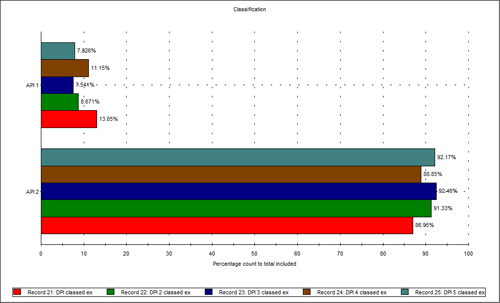
しかし、APIの相対的な割合を調べたところ、違いが見られた。 測定は5回繰り返して行った。図3化学的情報に基づいて分類した後で、2つのAPIの量を粒子数の割合で比較した結果を示す。 分析した製剤のサンプル中に存在するAPI 2の相対的割合が、API 1よりも高いことが明らかに分かる。
|
1つの装置に自動粒子画像解析機能とラマン分光分析機能を統合することで、混合剤や調合剤に含まれる成分を個別に特性評価し、比較することができる。 こうした装置を使用することで、製薬産業での規制対応から問題解決に至る多くの領域にわたって、製品の理解を深めることができるようになる。 しかも、これは製薬だけにとどまらず、ラマンスペクトルを得ることが可能な場合、その他のサンプルにも適用することができる。