タンパク質はポリペプチド鎖で構成されており、調製、保存、バッファーなどの様々な処理条件に敏感です。このアプリケーションノートでは、未処理製剤と処理製剤の2つの形態で提供される治療用抗体の動的および静的光散乱特性評価について説明します。処理プロセスに関する情報は明かされていません。
・・・続きはログイン(会員登録)することでお読みいただけます。
タンパク質はポリペプチド鎖で構成されており、調製、保存、バッファーなどの様々な処理条件に敏感です。このアプリケーションノートでは、未処理製剤と処理製剤の2つの形態で提供される治療用抗体の動的および静的光散乱特性評価について説明します。処理プロセスに関する情報は明かされていません。
2種類の未処理抗体サンプルは、リン酸アンモニウム緩衝液中7 mg/mLの濃度で提供されました。両サンプルはまた、様々な低濃度で処理された形でも提供されました。全てのサンプルは、0.1 µm Whatman Anotopフィルター(cat. 6809-1012)でろ過され、12 µLキュベットセル(ZEN2112)で測定されました。
その後、未処理サンプルの一連の希釈液を同じバッファーで調製し、静的光散乱法による分子量の測定と比較を行いました。
最後に、純粋なサンプルと処理したサンプルの両方について凝集点測定を行いました。凝集点は「Tm(melting point)」と呼ばれることもあり、タンパク質が変性する温度です。ゼータサイザーは自動温度スキャンが可能であり、凝集点温度を決定する計算を提供します。
流体力学的サイズ
動的光散乱測定では、処理サンプルと純粋サンプルの間に有意な差が見られました。純サンプルは11 nmの典型的なz平均径(d.nm)を示したのに対し、処理サンプルは50 nmのz平均径を示し、いずれも多分散性指数(PDI)が0.1より大きく、単一種以の存在が示されました。これは、図1に示す粒度分布分析によって確認されました。純粋なサンプルは、予想されるサイズに近い単一のピークを示したが、ピークは単一種の場合よりも広く、いくつかの断片やオリゴマー集合体の存在を示しています。処理されたサンプルは明らかに凝集し、大きさが大幅に増加していました。
図1: 純粋抗体サンプル(青)と処理抗体サンプル(赤)の粒度分布
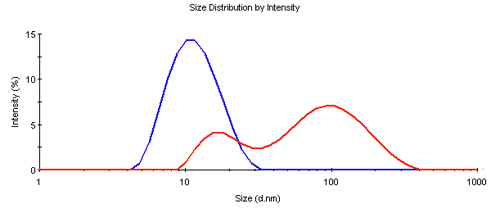
|
分子量
この結果は静的光散乱測定で確認されました。このサンプルの予想分子量は約145kDaでしたが、精製中に完全に除去されなかった抗体断片が存在していました。
静的光散乱法では重量平均分子量を計算しますが、表1に示すように、純粋な抗体サンプルは重量平均分子量が期待値よりわずかに小さい値を示しました。
この不一致は、より小さな断片の存在に由来する可能性が高いです。処理されたサンプルの分子量は純粋な抗体よりもかなり大きかったです。これは測定されたサイズ分布と一致します: 処理されたサンプルは大量の凝集体を含み、これが大きな平均分子量をもたらしました。ゼータサイザーでは、典型的なレイリー散乱体よりも大きなサンプルでも分子量を測定できます。処理したサンプルについては、球の形状補正(RG = 0.774 RH)をデータに適用しました。分子量への影響は10%未満でした。
表1: 純抗体サンプルと処理済み抗体サンプルの分子量、予想分子量 145 kDa
| Sample | MW (kDa) | MW error (kDa) |
|---|---|---|
| San2-pure | 129 | +/- 21 |
| San3-pure | 139 | +/- 8 |
| San2-treated | 1210 | +/- 125 |
| San3-treated | 1270 | +/- 65 |
凝集点
サンプルチャンバーの自動温度スキャンにより、サイズと散乱強度の両方を温度の関数として観察できます。サイズと強度の両方が著しく増加し始める点を凝集点と呼びます。ここでは、分子の変性が大規模な凝集を引き起こし、それがサイズと散乱強度の両方として現れています。
図2は、純粋な抗体サンプルの凝集点測定を示しています。強度のプロットには、約56℃で明確な転移が見られます。ヒステリシス点は、温度を20℃に戻したときのサイズと強度の値を示しています。これは、温度を下げるだけでは変性が可逆的ではないことを示しています。
一方、図3に示した処理サンプルは、全く転移を示しません。これは、独自の処理が温度と同様の効果を発揮して抗体を変性させたようです。
図2:未処理サンプルの凝集点測定。TM = 56 °C
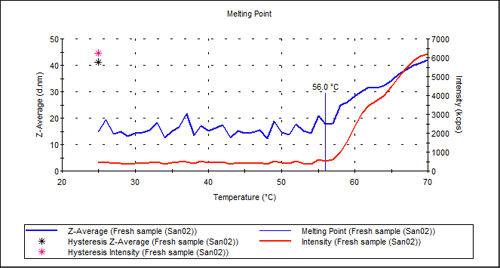
|
図3:処理した抗体サンプルに凝集点は見られなかった。
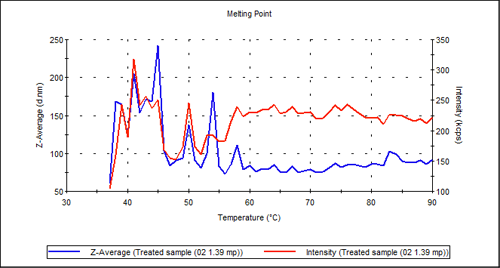
|
この実験では、供給された2つの試料を区別し、未処理試料の凝集点を計算できる技術の能力が明確に示されました。処理されたサンプルは変性プロセスを経ており、凝集点は観察されなかったと推測されます。