ヒト血清アルブミン(HSA)は肝臓で合成される球状輸送タンパク質である。 これはヒトの血漿において最も豊富なタンパク質であり、ヒト血清タンパク質の半分を構成している。 HSAはホルモンや脂肪酸の輸送を主な機能としている。 HSAはCa2+、Na+、K+などのさまざまなカチオンに強く結合することが確認されており、血液を基にした医薬品の輸送機構となることが多い。
小分子輸送機能に加えて、HSAは血液系中の膠質浸透圧とpHの維持と調節という役割も担う。 HSAが失われると、膠質浸透圧の低下により、即座に血管透過性が高まり、動脈と静脈が膨張することがある。 膠質浸透圧は束一性であるため、HSAにおけるオリゴマーの平衡を理解することが重要である。
サイズ排除クロマトグラフィー(SEC)またはゲル浸透クロマトグラフィー(GPC)は、タンパク質混合物の精製、同定、定量化のために製薬の研究室で一般的に使われている技術である。 SECはサイズに基づいて材料を分離する物理的な方法である。 溶出を示すグラフから、その混合物のオリゴマー成分に関する情報が得られ、そのグラフは粒度分布として解釈できる。
本研究では、屈折率検出器、光散乱検出器、粘度検出器、GE Superdex 200カラムを備えたViscotek TDAmaxシステムを使って、ヒト血清アルブミンの特性評価を行った。 既知の分子量66kDaの新鮮なHSAタンパク質を、7.5 mg/mLの濃度で0.1 M PBS中に調製した。 100μLのサンプルを、流量0.5mL/min、温度35℃で動作しているViscotekシステムに注入した。
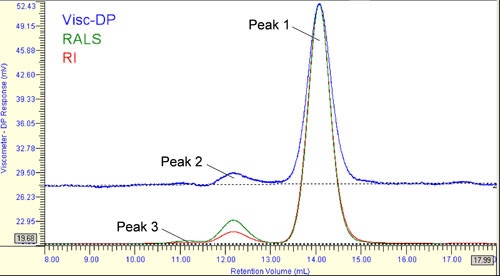
PBS中のHSAのSECクロマトグラムを図1に示す。ここでは屈折率検出器(RI)信号は赤色、直角光散乱(RALS)信号は緑色、粘度検出器の信号は青色で示している。 このクロマトグラムはViscotek OmniSECソフトウェアから直接抽出したものであり、14、12、11mlの溶出量において3つのピークを示している。 このグラフで、ピーク3が粘度グラフのベースラインから識別できないことの理由は、 本報告の後半で述べる。
|
SECでは、小さい分子ほどカラム充填剤の細孔の奥に浸透する。 その結果、そのような分子はカラム中に保持される時間が長くなり、保持量(または時間)が大きい(長い)ほど分子が小さいことを示す。 したがって、図1に示すクロマトグラムでは、13mLと15mLの間で溶出しているピーク1はモノマー、ピーク2とピーク3はより高次のオリゴマー形態のHSAであることが予測できる。
一般的なSECでは、ピーク1がモノマーであると仮定した場合、構造が類似している分子量が既知の基準物質を用いてカラムを校正することにより、ダイマーなどの分子量を求める。 しかし、Viscotek TDAmaxのようなマルチ検出SECシステムの場合、タンパク質のサイズ、分子量、粘度を直接測定することができるため、多数の標準サンプルを用いた、時間がかかり、直接性でも劣るカラム校正を行う必要がない。
溶液中の小分子の集合体による散乱光を表すレイリーの式を下に示す。ここでKは光学定数、Cは濃度、Mwは重量平均分子量、A2は第二ビリアル係数、Rθは角度依存散乱光強度を表す。
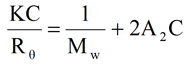
|
SEC測定における希薄条件では、この式をさらに簡略化し、下に示す形に整理しなおすことができる。ここでK'は光学定数とレイリー比の比例定数を組み合わせたものであり、Iは光散乱検出器で測定した強度を表す。
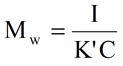
|
上記の式で明らかなように、サンプル濃度が既知であれば、重量平均分子量を散乱強度測定値から直接求めることができる。 TDAmaxのようなマルチ検出SECシステムの場合、サンプル濃度は、屈折率検出器またはUV検出器から得られる。
粘度検出器を搭載したSECシステムの場合、RI信号から得られた濃度を使って、固有粘度([η])を求めることもできる。 希薄サンプル濃度の場合、固有粘度は、下に示す式に従って、粘度検出器で測定した溶液の粘度の粘度(η)と溶媒の粘度(ηo)に関係付けられる。ここでCはRIから得られたサンプル濃度を表す。
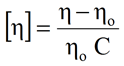
|
マルチ検出SECシステムでは、固有粘度から流体力学的半径(RH)も得ることができる。 アインシュタインは、球体の希薄溶液の粘度が、下に示すように球体の体積分率(φ)に関係することを示した。
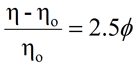
|
固有粘度の式と組み合わせると、アインシュタインの式は次のように書き直すことができる。
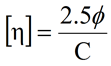
|
球体体積と濃度の定義を用いることで、上記の式は次に示すようにさらに拡張し、整理しなおすことができる。ここでMは分子量、NAはアヴォガドロ数、RHは流体力学的半径を表す。
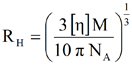
|
固有粘度と分子量はTDAmaxシステムに注入されたサンプルの測定値であるため、上記の式からSEC測定中の溶出分に対する流体力学的半径を求めることができる。
表1は、HSA実験の3つのピークにおける測定サイズ、固有粘度、重量平均分子量、さらにこのタンパク質のオリゴマーの質量分率を比較したものである。 ピーク1の分子量測定値は、モノマーのHSAの分子量として報告されている66kDaと合致している。 ピーク2はMwが137kDaであるため、このタンパク質のダイマーと同定される。 ピーク3のMw測定値は、このタンパク質のトライマーとテトラマーのおよそ中間に位置する。
| ピーク1 | ピーク2 | ピーク3 | |
|---|---|---|---|
| 分子量Mw(kDa) | 66.6 | 136.7 | 242.2 |
| 固有粘度 - [η] (dL/g) | 0.0298 | 0.0354 | 未解決 |
| 流体力学的半径 – RH (nm) | 3.2 | 4.2 | 未解決 |
| 質量分率 | 94.4% | 5.2% | 0.4% |
| オリゴマーの形態 | モノマー | ダイマー | トライマー/テトラマー |
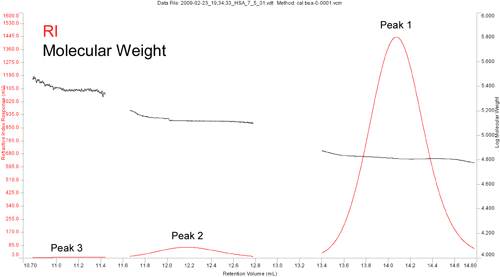
タンパク質は分離したオリゴマー構造を形成する傾向があるため、トライマーとテトラマーの中間にあるピーク3の分子量は、一見するとエラーのように思える。 図2は、RIのクロマトグラムの拡大図と、各ピークにわたって測定した分子量を示したものである。 この図から分かるように、ピーク3はベースラインからほとんど識別できず、Mwが広い範囲にまたがっている。 したがって、報告されたような中間に位置する値は、このタンパク質のトライマーとテトラマーがクロマトグラフィーで十分に分離しなかった結果である可能性が高い。
|
球状タンパク質の流体力学的半径を推定する有名な関係式を式7に示す。 この式は動的光散乱法(DLS)で行った多くのタンパク質測定から得られたものである。 Viscotek TDAmaxで行った分子量とサイズの測定値は、実験で得られたこの関係式を必要としないが、その実験結果をTDAmaxで測定された絶対的な結果と比較することは有益である。 66kDaのHSAタンパク質のモノマー、ダイマー、トライマーおよびテトラマーの場合、式7によると、流体力学的半径はそれぞれ3.6、4.8、5.7、6.5nmと予測される。 モノマーとダイマーに対する流体力学的半径の予測値は、TDAmaxによる測定値と合致している。 わずかに違いがあるが、式7を作成する際に、すべてのDLS測定から矛盾をなくすために使われた平均の重み付けに由来する可能性がある。 また、この違いは、HSAのような非球状分子に対する形状因子の処理にも由来している可能性がある。その処理では、シムハ係数をストークス - アインシュタインの式に適用すると、報告されているサイズと若干異なる値が得られる。
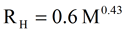
|
HSAに関する研究において、Kiselevらは、 中性子小角散乱からの回転半径(Rg)として2.74nmを報告した。 Schmitzによれば、この回転半径を使うことで、下に示す剛体球に対する関係式から流体力学的半径を予測することができる。 Kiselevが報告した2.74nmのRgにこの式を適用することで、3.5というRH推定値が得られる。これは上記で示したように、Viscotekシステムで測定したRH3.2nmと合致する。
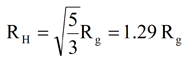
|
最後に、RHとRgの物理的な意味を検討することは有益である。 流体力学的半径は、測定対象のタンパク質と同じ速度で拡散する剛体球の半径として定義される。 一方、回転半径は、分子の質量中心から各質量要素までの質量加重平均距離として定義される。 これらの定義はいずれも、分子の中心から外面までの距離とされる一般的な半径の定義とは異なっていることに注意してほしい。
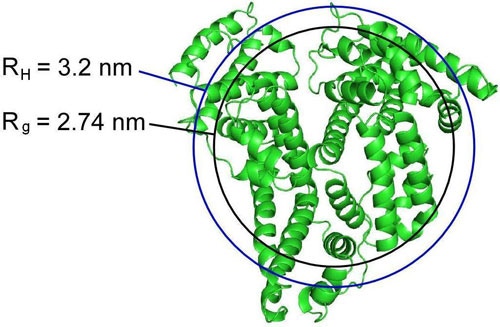
図3は、リボン構造のタンパク質上にRHとRgの半径を重ねたものである。 この図で分かるように、実験で測定された半径値はいずれも、タンパク質全体を囲む球体半径とは一致していない。ただし、このタンパク質の場合、流体力学的半径で定義される球体はこのサイズに近づいている。
|
Chaubal, M. “Human Serum Albumin as a Pharmaceutical Excipient” Drug Delivery Technology2005, Vol.5 No.8
Human Protein Reference Database [http://www.hprd.org/]
Kiselev, M; Gryzunov Y.; Dobretsov G.; Komarova M. “The Size of Human Serum Albumin Molecule in Solution”, Research Institute of Physicochemical Medicine, Moscow, Russia, 2000
Matejtschuk, P.; Dash, C.; Gascoigne, E “Production of human albumin solution: a continually developing colloid” British Journal of Anaesthesia, 2000, Vol. 85, No. 6: 887-895
Roche, M.; Rondeau, P.; Singh, NR.; Tarnus, E.; Bourdon, E.” The antioxidant properties of serum albumin” Laboratoire de Biochimie et Génétique Moléculaire, Université de La Réunion, Saint Denis de La Réunion, France. Federation of European Biochemical Societies Letters, 2008 Vol. 582, No. 13:1783-1787
Schaller, J.; Gerber, S.; Kampfer, U.; Lejon, S.; Trachsel, C.; Human Blood Plasma Proteins Structure and Function.John Wiley and Sons, 2008 John Wiley and Sons, 2008
Schmitz, S.K. “An Introduction To Dynamic Light Scattering By Macromolecules”, Academic Press, New York, 1990

|