サイズ排除クロマトグラフィー(SEC)は、生物科学の分野で一般的に使用されるツールである。 従来の SEC では、分子量が分かっている標準試料の溶出時間と、未知の試料の溶出時間を比較することで、未知の試料の分子量を決定する。 このとき、UV 検出器または、屈折率(RI)検出器のどちらかを、濃度検出器として単独で用いる。 これに対し、高度なマルチ検出 SEC システムでは、UV 検出器、RI 検出器、光散乱検出器、固有粘度検出器の、最大で 4 種類の検出器を備える。 光散乱検出器では、カラムのキャリブレーションを行わずに、散乱光強度から直接、分子量を測定することができる。 粘度検出器で測定される固有粘度は、分子密度の指標であり、そこから分子の構造変化を推定することができる。 光散乱と固有粘度を組み合わせることで、分子の大きさを計算することができる。

|
これら 4 つすべての検出器において、最大の応答感度を維持するには、配管を分岐せず、各検出器を直列に接続することが重要である。
SEC は一般的に、純度の高い試料の測定に使用される。 本アプリケーションノートでは、マルチ検出器を使用したSECシステムで、1 回の測定により、4 種類のタンパク質の混合物の特性評価を行った結果を紹介する。 RI 検出器に対するタンパク質の反応は、タンパク質の種類によらず、概して一貫していることから、RI 検出器はタンパク質全体の濃度検出器として有用である。一方、UV 検出器は、タンパク質の種類によって各波長の吸光係数異なるため、個々のタンパク質の濃度を測定することが可能である。 UV検出器は、バッファー成分によるピークが RI 検出器信号に影響する領域に溶出するタンパク質に特に有用である。 最後に、光散乱測定により、各ピークの分子量を同定することができる。
使用した 4 種類のタンパク質は、グルコースオキシダーゼ、ラクトペルオキシダーゼ、ラクトフェリン、リゾチームである。
pH4.5 のリン酸緩衝液を使用し、試料を流した。使用したタンパク質のうち 2 種類がこの pH レベルで回収率が高くなることが分かっていたためである。 シリカベースの Viscogel P カラムを使用し、測定は、UV 検出器、RI 検出器、光散乱検出器、粘度検出器を直列につないだ 4 段検出システムである Viscotek TDAmax システムを使用して行った。
試料すべての dn/dc を 0.185ml/g として計算を行なった。 リゾチームについては、吸光係数(E280 1mg/ml)として 2.64 を使用した。
単体では 3mg/ml の試料を流し、混合したときはそれぞれ 0.3mg/ml の試料を流した。 注入量は 100μl とした。
4 種類の酵素それぞれを別々に流し、その溶出時間と分子量を測定し、混合物を使った実験と比較した。
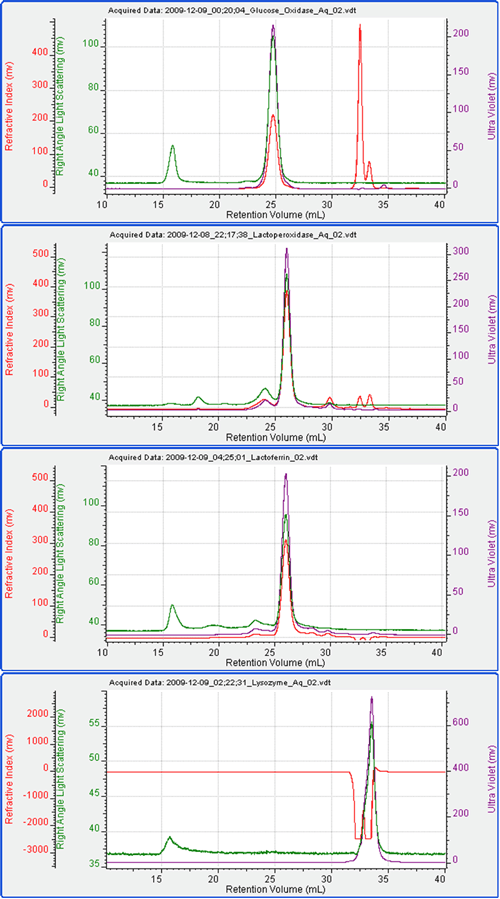
図 2 は、4 種類のタンパク質ぞれぞれを単体で測定したときのクロマトグラムである。 表 1 は、既知の分子量、単体で流したときの分子量測定値、RI 検出器のピーク領域のデータを示す。
|
| 既知の分子量 (kDa) | 分子量測定値 (kDa) | RI ピーク領域(mV ml) | |
|---|---|---|---|
| グルコースオキシダーゼ | 160 | 134.5 | 20.6 |
| ラクトペルオキシダーゼ | 78 | 77.7 | 28.71 |
| ラクトフェリン | 80 | 83 | 28.05 |
| リゾチーム | 14.7 | 14.7 | 不明 |
この条件下では、4 種類のタンパク質はいずれもよく流れたことが分かる。 測定した分子量は、予測値に近かった。 唯一の例外は、グルコースオキシダーゼの分子量が、予測値 160kDa であったのに対し、測定値が 130kDa であったことである。 この差についてはここでは検証しないが、何らかの変性が示唆される。 リゾチームは、RI 信号に塩 / 溶媒のピークが大きな影響のある領域で溶出した。 したがって、リゾチームに関してはUV 信号を用いて濃度を測定し、分子量を計算した。
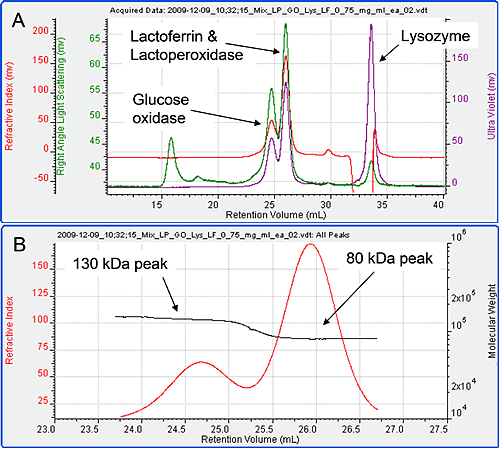
図 3 は、4 種類の試料を同量混合したものから得たクロマトグラムである。 得られたクロマトグラムでは、ピークが 3 つしか認められなかった。 直観的にも、最初のピークはグルコースオキシダーゼ、2 番目のピークはラクトペルオキシダーゼとラクトフェリン、3 番目のピークはリゾチームと考えられるが、このことは、検出器の信号と結果からはっきりと確認できる。 光散乱のデータから、3 つのピークの分子量を調べた。 最初のピークの分子量は 130kDa、2 番目のピークの分子量は 80kDa であることが分かった。 3 番目のピークの分子量は 15kDa と測定され、これがリゾチームであることが分かる。 最初の 2 つのピークは部分的にしか分離できなかった。
|
しかしながら、2 つのピークが重なる領域を、光散乱と RI により得られたデータから計算される分子量を用いてプロットすることで(図 3B)、単分散領域をはっきりと特定でき、その分子量を正確に求められるため、それぞれのピークの分子量を明確に同定することが可能である。 したがって、最初のピークは明らかにグルコースオキシダーゼである。
2 番目のピークはラクトペルオキシダーゼかラクトフェリンのいずれか、または両方である。 未変性タンパク質の dn/dc は、タンパク質の種類によらず、0.185ml/g でほぼ一定である。 したがって、RI 信号は総タンパク量の指標ととらえることができる。 このクロマトグラムの 2 番目のピークの RI ピーク領域は 55.43mV ml である。 これは、ラクトフェリンとラクトペルオキシダーゼという 2 種類のタンパク質を単体で同じ濃度で流したときの RI ピーク領域の合計と非常に近い(28.7 + 28.05 = 56.75 mV ml)。 したがって、2 番目のピークは実際にラクトペルオキシダーゼとラクトフェリン両方のものであると結論づけることができる。
複数の検出器を組み合わせることにより、1 種類の濃度検出器のみを使用する場合に比べて、1 回の実験結果からより多くの情報を抽出することができる。
第一に、タンパク質混合物では、RIを総タンパク量の指標として利用できるため、 個々のタンパク質の吸光係数とは無関係にタンパク質を定量化できる。 第二に、UV は、リゾチームなどの非常に小さなタンパク質は、しばしば測定の終了まぎわに生じる RI 検出器の溶媒のピークに重なって溶出する場合に有用である。 第三に、光散乱を利用して分子量を測定することで、部分的にしか分離できないピークを、はっきりと同定することが可能となる。
総じて、マルチ検出 SEC は、単一の検出器のみを使用する従来のシステムに比べ、大きな進歩を遂げたと言える。 分子量はカラムのキャリブレーションをすることなく測定でき、混合物のピーク分離の適用範囲が広く、単一のクロマトグラム中から、以前では得られなかった情報の抽出が可能である。