Caracterização de confiança da estabilidade da proteína
A Calorimetria de varredura diferencial (DSC) é uma técnica analítica usada para caracterizar a estabilidade de uma proteína ou outra biomolécula diretamente em sua forma nativa. Ela faz isso por meio da medição da alteração de calor associada à desnaturação térmica da molécula quando aquecida a uma taxa constante.
Uma biomolécula em solução é um equilíbrio entre suas conformações nativas (dobradas) e desnaturadas (desdobradas). Quanto maior o ponto médio de transição térmica (Tm), mais estável é a molécula. A DSC mede a entalpia (∆H) de desdobramento que resulta da desnaturação induzida por calor. Ela também é usada para determinar a alteração na capacidade de calor (ΔCp) da desnaturação. A DSC pode elucidar os fatores que contribuem para o dobramento e a estabilidade de biomoléculas nativas. Eles incluem interações hidrofóbicas, ligações de hidrogênio, entropia conformacional e ambiente físico.
Os dados precisos e de alta qualidade obtidos do DSC fornecem informações vitais sobre a estabilidade da proteína no desenvolvimento do processo e na formulação de candidatos terapêuticos potenciais.
As macromoléculas e os conjuntos macromoleculares (>5000 Daltons), como proteínas, ácidos nucleicos e lipídeos, podem formar estruturas bem definidas que suportam mudanças conformacionais induzidas termicamente. Essas reorganizações estruturais resultam na absorção do calor causado pela redistribuição de ligações não covalentes. Os calorímetros de varredura diferencial medem essa absorção de calor.
O núcleo térmico de um sistema DSC é composto de duas células, uma referência e uma célula de amostra.
O dispositivo foi projetado para manter as duas células na mesma temperatura à medida que elas são aquecidas.
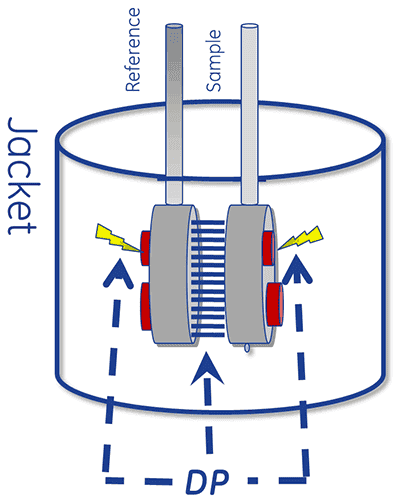
Para fazer uma medição de DSC, a célula de referência é a primeira preenchida com tampão e a célula de amostra com a solução de amostra. Elas são aquecidas a uma taxa de varredura constante.
A absorção de calor que ocorre quando uma proteína é desdobrada causa uma diferença de temperatura (ΔT) entre as células, resultando em um gradiente térmico pelas unidades Peltier. Isso configura uma tensão, que é convertida em potência e é usada para controlar a Peltier para retornar ΔT (o diferencial de temperatura) a 0 °C. Alternativamente, as células podem ser autorizadas a alcançar o equilíbrio térmico passivamente através da condução.
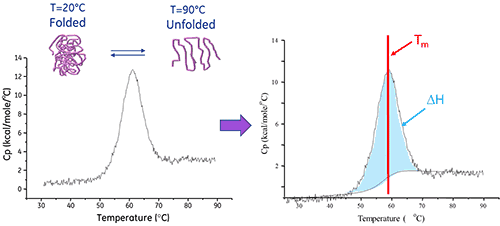
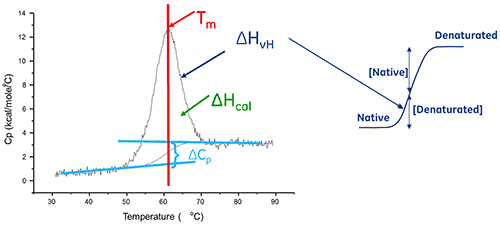
A entalpia de desdobramento de proteínas é a área abaixo do pico de DSC de concentração normalizada e tem unidades de calorias (ou joules) por mole.
Em determinados casos, os modelos termodinâmicos podem ser ajustados aos dados para obter a energia livre de Gibb (ΔG), a entalpia calorimétrica (ΔHcal), a entalpia de van't Hoff (ΔHvH), a entropia (ΔS) e a mudança da capacidade de calor (ΔCp) associada à transição.
A análise da Calorimetria de varredura diferencial é amplamente utilizada para a descoberta e o desenvolvimento de medicamentos. As aplicações principais incluem:

MicroCal PEAQ-DSC AutomatizadoAnálise padrão-ouro da estabilidade de proteínas para ambientes regulamentados |

MicroCal PEAQ-DSCAnálise padrão-ouro da estabilidade de proteínas para aplicações em pesquisas |
|
|---|---|---|
| Tipo de medição | ||
| Análises Livre de Marcadores | ||
| Estabilidade de proteínas | ||
| Tecnologia | ||
| Calorimetria de varredura diferencial (DSC) | ||
| processamento de amostra | ||
| Faixa de temperatura | ||