在本应用报告中,ITC 和 DSC 实现了对蛋白质-辅料结合的表征,这两者的结合是复杂的蛋白质溶液制剂中可能存在的多种相互作用之一。
Biopharmaceutical Technologies, GlaxoSmithKline R&D, 709 Swedeland Rd,
King of Prussia, PA 19406 (USA)
由于蛋白质内在的不稳定性,其中既有物理不稳定性(去折叠、聚合、吸附),又有化学降解性(氧化、脱酰胺、分裂),所以基于蛋白质的治疗药物的发展面临着巨大的挑战。 蛋白质的不稳定可以导致蛋白质活性降低甚至可能产生潜在的免疫原性。 为增加蛋白质的稳定性,可以尝试改变蛋白质所在溶剂的性质,包括谨慎选择缓冲液系统,调节 pH 值,添加辅料/添加剂,即研发最佳制剂。
蛋白质药物制剂稳定性的重要因素之一是选择适当的辅料,同样重要的是优化辅料浓度,从而延长药物的保质期,同时确保对病人的最大安全性。 因而蛋白质药物制剂研发的一个重要环节是辅料的选择,它需满足以下条件:溶解度合适,无毒,可维持结构的完整,保证较长的保质期,以及保持产品的生物活性。 这样的辅料包括氨基酸、盐、金属、表面活性剂、糖、多元醇和聚合物。 这些物质可作为稳定剂、表面活性剂、抗菌防腐剂或抗氧化剂。 辅料的稳定作用通常具有蛋白质特异性和浓度依赖性。
在辅料选择环节,不仅需要进行辅料浓度优化的信息,也要了解各种制剂成分间的相互作用。 每种辅料的选择和辅料浓度的优化都需要进行大量的制剂筛选和稳定性研究,是十分费时费力的工作。 过去十年间一些文献报道了维持稳定性的一般准则 (1),但是在储存期间辅料是如何提升蛋白质药物的稳定性,其机制尚未完全明晰。 了解辅料与蛋白质间的相互作用的机理,可以减少纯经验的筛选方法,从而理性研发和优化蛋白质制剂,减少蛋白质药物研发过程中的时间消耗和材料损耗。 另外,掌握蛋白质-辅料间的相互作用的强度及类型信息有助于预测蛋白质药物在体内的行为。
生物物理学分析方法在制剂研发的辅料筛选中发挥极其重要的作用。 特别是量热法,其被视为评估蛋白质稳定性和相互作用的最有效方法之一,因为其可实现系统全面的热力学表征,前提是所有活动均可逆。 量热法研究用于探索蛋白质-辅料间的相互作用,该方法已经越来越多地用于生物制剂的研发和优化。 量热法的工作原理是通过测定缔合、解离和/或去折叠过程中所产生的热能改变,来确定大分子相互作用的热力学和化学计量。 ITC 主要用于确定热力学结合参数(例如结合亲和力和解离常数)、以及化学计量、焓、熵及等温条件下结合的吉布斯自由能。 该方法也可通过在各种温度下进行实验来测定结合后的热容变化。 DSC 数据提供蛋白去折叠过程的热力学参数,包括中点去折叠温度、焓、熵、吉布斯自由能以及去折叠过程的热容变化。
这些热力学参数常用于比较不同制剂中蛋白质的稳定性或确定特定辅料的相对稳定或不稳定的作用。
本应用报告提供了量热法如何通过探知辅料-蛋白质间的相互作用辅助 ProX 制剂研发的例子。 在这里将聚山梨醇酯-80 和苯酚作为 ProX 制剂缓冲液可能的添加剂进行检测。 聚山梨醇酯-80 是一种常用表面活性剂,可以用来预防蛋白质的非特异性吸附和聚合,之前的研究已经显示其与蛋白质的相互作用 (2, 3)。 它与暴露于蛋白分子表面的疏水区结合以阻止蛋白发生表面聚合 (3)。 聚山梨醇酯-80 最常用的浓度水平为 0.002-0.1% (w/v)。 苯酚作为抗菌剂,用于需从同一容器多次投药的制剂。 苯酚有一定毒性,因而在制剂缓冲液中应保证使用最小浓度。 最常用的浓度水平为 0.3-0.5% (v/v)。
使用 MicroCalTM VP-Capillary DSC 进行实验。 各样品取 400 μl,与其匹配缓冲液一起置于 96 孔板中。 样品在 25℃-100℃ 条件下扫描,扫描速率为每小时 60℃,每次扫描前平衡 15 分钟。 数据通过 Origin(第 7 版)软件进行分析,预先扣除缓冲液背景并校正扫描蛋白质的浓度。
使用 MicroCal iTC200 进行实验。 在样品池中添加 250 μl 浓度为 10 mg/ml 或 25 mg/ml 的 ProX,滴定注射器中注入 40 μl 含有 60 mM 苯酚或 50 mM 聚山梨醇酯-80 的与 ProX 相同的缓冲液。 参比池中添加去离子水。 每次实验中 40 μl 滴定液以每秒 0.5 μl 的速度注入样品池,每次体积为 0.2-2μl。 仪器所用设置如下:搅拌速度 1000 rpm,参考能量为每秒 5-8μCal,反馈模式/增益设置为高,温度为 25℃,初始延迟 60 秒。 作为对照反应的缓冲液注入缓冲液、滴定液稀释及 ProX 稀释均从每次实验中扣除。 使用 Origin(第 7 版)分析数据。 在使用 ITC 方法研究样品前,使用 0.2 μm 低蛋白质结合注射器过滤器过滤样品,且每种蛋白质样品透析所用缓冲液应与配置辅料溶液所用缓冲液相同,以确保注射器和测量池中的缓冲液匹配。
辅料与药品中活性成分直接结合可对该产品造成多方面的影响。 最新研究表明药剂中一些常用辅料可能影响药物活性成分的药代动力学 (4, 5)。 辅料也可能改变蛋白质药物的结构或生物学活性,从而导致药效的改变。 除了在药代动力学方面或活性成分效力可能的改变,辅料/蛋白质间的相互作用也可改变保质期或药物的使用安全性。 因此我们需要认识和了解蛋白质与药剂辅料间的相互作用。 如果可以检测出蛋白质和溶液辅料的直接作用(即可测定的结合),则应在蛋白药物制剂研发中考虑以下两个重要因素:第一,辅料与蛋白结合的结合强弱和/或可逆性,因为临床用药后这种结合可能阻碍或完全遮挡药物蛋白表面的某个重要活性位点;第二,未结合辅料的浓度,该浓度应足以满足所需溶液特性。 下面将以 ProX 为例分别进行阐述。
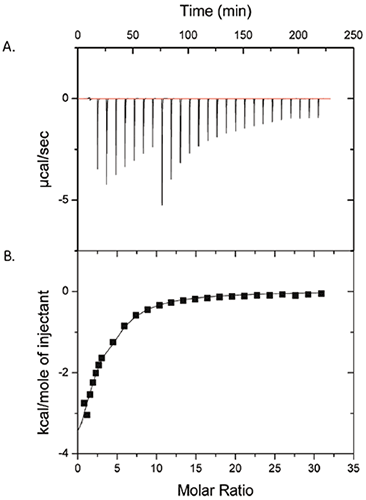
图 1 显示了 50 mM 聚山梨醇酯-80 注入 25mg/ml ProX 的 ITC 试验结果。 原始数据见 (A) 部分,已扣除对照组背景的每次注射积分热见 (B) 部分。 (B) 部分数据表明聚山梨醇酯-80 与 ProX 之间存在可测量的相互作用。 数据经单结合位点模型拟合计算得结合亲和常数 (KA) = 1430 ± 260 M-1,结合焓 (ΔH) = -6.3 ± 1.1 kcal/mol,每个 ProX 分子结合位点数 (n) = 2.6 ± 0.3。 结合熵变 (ΔS) 为 -6.7 ± 3.7 cal/mol-K。
|
由图 1 等温线可知,当聚山梨醇酯-80 与 ProX 分子摩尔比接近 10 时,ProX 上的聚山梨醇酯-80 结合位点饱和。 聚山醇酯-80 在纯水中的临界胶束浓度 (cmc) 为 0.012 mM,在蛋白溶液中已有报道最高可达 0.1 mM (2)。 图 1 所示 ITC 实验中聚山醇酯-80 浓度范围为 0.1 mM 至 7 mM,即使在第一次注射后其浓度就已经超过 CMC 值。 这一信息很重要,因为如此一来任何可测的相互作用都应该归功于蛋白质与表面活性剂胶束而非单体的结合。
在制剂研发中,掌握结合参数的相关知识可以帮助我们选取足以“饱和”并稳定蛋白质的最低结合辅料浓度。 将制剂中辅料的浓度降到最小不仅可以降低成本,而且能够减少给病人服用添加剂的量。 在这个特定案例研究中,每个分子对应 10 倍摩尔过量的聚山梨醇酯-80 即足以饱和此蛋白。 另外,结合参数也可用于预测蛋白质-辅料复合物在体内的行为;所以 ITC 测出的结合常数偏小,意味着药物进入体内经血液稀释后,ProX/聚山梨醇酯-80 复合物将解聚,从而不影响蛋白质药物的生物活性。
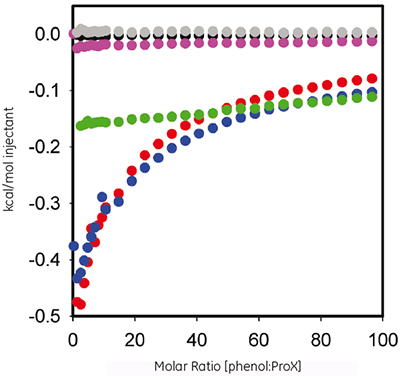
苯酚可用作 ProX 制剂的抗菌剂。 在这里我们使用 ITC 评估蛋白质与防腐剂间任何可测量结合的热力学。 图 2 标记出 60 mM 苯酚滴定 10mg/ml ProX 时不同摩尔比下每次注射的热量,缓冲液 pH 值分别为 5.7、4.5 和 3.5,图中数据均已扣除对照组背景。
|
ITC 数据显示 ProX 在 pH 5.7 和 4.5 时可与苯酚相互作用,在 pH 3.5 时无作用。 最终得到的曲线无法与任何预定义的结合模型拟合,这指示结合活动非常复杂且涉及多个位点。
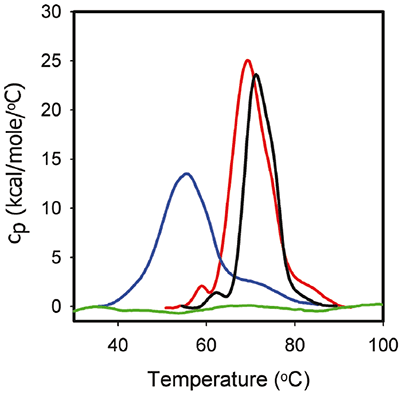
图 3 显示了 1mg/ml ProX 在制剂缓冲液中的 DSC 曲线,所用缓冲液与 ITC 实验相同。 相应的 DSC 数据显示,在 pH 为 5.7 且不存在苯酚的条件下,ProX 在中点去折叠温度 Tm1、Tm2 和 Tm3 分别为 59℃、68℃ 和 85℃时,至少发生三次去折叠跃迁,中间的跃迁代表主去折叠活动。 去折叠总焓 (ΔHunf) 为 270 kcal/mol。 在 pH 为 4.5 时,检测不到第一次跃迁。 主去折叠活动的 Tm2 为 55℃,Tm3 下降到 73℃。 ΔHunf 降低到 216 kcal/mol,表示三级相互作用力强度的减弱。 最终在 pH 为 3.5 时,DSC 数据显示检测不到任何去折叠跃迁,这指示 ProX 在酸性条件下去折叠。
|
图 3 还显示了 ProX 在 pH 为 5.7 的苯酚缓冲液中去折叠的 DSC 热分析图。 值得注意的是,苯酚使 Tm1 增加 1°C,使 Tm2 增加 2°C,而使 ΔHunf 降低至 195 kcal/mol。 但是存在或不存在苯酚时 ProX 的三级结构是相同的(通过荧光性等其他生物物理表征数据确定,数据未显示)。 通过其他方法可知,一般而言,DSC 行为的改变与结构改变相关联;然而事实上并非总是这样。 DSC 的变化被认为是由于维系天然蛋白质结构稳定的力遭到破坏(例如范德华力、疏水力和静电作用力、氢键等),以及暴露残基的水合作用。 三级作用不稳定会降低蛋白质结构的紧密度,DSC 可以在不诱导蛋白质结构发生改变的情况下检测到这一现象,而其他方法不可以。
ITC 和 DSC 数据相结合揭示了苯酚-蛋白质间相互作用的重要信息。 首先,苯酚可与折叠的 ProX 结合,无法与去折叠的 ProX 结合(图 2);因此 ProX 只有具备完整的三级结构才有可与苯酚结合的位点。 第二,由于蛋白质发挥功能需要具备完整的三级结构,因而 pH 5.7 视为制剂的最优 pH 值。 第三,如图 2 所示,在苯酚与 ProX 摩尔比高于 50 时,两者的结合完全饱和。 第四,DSC 试验(在含有 0.005% (v/v) 苯酚的 pH 5.7 制剂缓冲液中添加 1mg/ml ProX)在苯酚与 ProX 摩尔比定为 38 时进行,此时两者的结合接近但不到完全饱和。 第五,虽然结合位点未饱和,但该摩尔比足以提高 ProX 的热稳定性。
结果表明,在存在 ProX 时,苯酚的抗菌活性会下降(数据未显示)。 在已知苯酚与 ProX 结合的基础上,此观察结果指示已结合的苯酚与未结合的苯酚相比抗菌活性降低,甚至可能为零。 在结合曲线的帮助下,可为制剂选择略高于饱和-结合点的苯酚浓度,在此情况下,未结合苯酚的浓度允许有效的抗菌活性。 在存在苯酚时 ProX 的 Tm 值增加在开始并未预测到;但这指示热稳定性提高,即蛋白质的长期稳定性更佳。 苯酚诱导的稳定化与苯酚的抗菌效果之间无直接关联。
通过使用 ITC 和 DSC,发现了苯酚在 pH 5.7 时结合折叠的 ProX,且聚山梨醇酯-80 也可与 ProX 结合,并揭示了其间的热力学特性。 通过测定 ProX 与聚山梨醇酯-80 的结合常数,可知两者的相互作用力较弱;并由此预测在体内环境下,活性蛋白可从制剂中稳定的辅料上解离,这意味着辅料对蛋白药物所有生物学功效的影响极小。 基于 ProX-苯酚滴定饱和曲线,为生产出抗菌能力强及热稳定性好的制剂,应选用高于饱和点的苯酚浓度。 ITC 和 DSC 的使用不仅能够确证辅料的结合,而且能够确定这两种辅料的最佳浓度(高于 CMC 的浓度,且每个 ProX 分子对应 10 倍摩尔过量的聚山梨醇酯-80;每个 ProX 分子对应 50 倍摩尔过量的苯酚)。
蛋白质产品制剂的生产要求包括安全与高效。 添加合适的辅料可以制造安全有效的蛋白治疗药物,并增加产品的稳定性及保质期,这就需要我们了解蛋白质与辅料在分子水平的相互作用。 在本应用报告中,ITC 和 DSC 实现了对蛋白质-辅料结合的表征,这两者的结合是复杂的蛋白质溶液制剂中可能存在的多种相互作用之一。
Arakawa, T., et al, Factors affecting short-term and long-term stabilities of proteins. Adv. Drug Deliv. Rev. 46, 307-326 (2001).
Chou, D. K., et al, Effects of Tween 20 and Tween 80 on the stability of Albutropin during agitation. J. Pharm. Sci. 94, 1368-1381 (2005).
Bam, N. B., et al, Tween protects recombinant human growth hormone against agitation-induced damage via hydrophobic interactions J. Pharm. Sci. 87, 1554-1559 (1998).
Ren, X., et al, Pharmaceutical excipients inhibit cytochrome P450 activity in cell free systems and after systemic administration. Eur. Jour. Pharm. Biopharm. 70, 279-288 (2008).
Taheri-Kafrani, A., et al, T. Beta-lactoglobulin structure and retinol binding changes in presence of anionic and neutral detergents. J. Agric. Food Chem. 56, 7528-7534 (2008).