本应用报告主要探索了等温滴定量热法 (ITC) 在激酶抑制剂研究领域的应用,并提及了差示扫描量热法 (DSC) 在研发过程中的作用。
生物体的激酶组是其基因组中的一组蛋白质激酶,这些蛋白修饰酶是很多治疗领域的潜在靶标。 近年来关于表征人类激酶组的研究和对可用激酶晶体结构的探索导致对激酶作为药物干预潜在靶标的关注日益增加。
自从制药行业在 20 世纪 80 年代末开始关注激酶起,研发的大多数激酶抑制剂都以酶的 ATP 结合位点为靶标。 然而,Gleevec™ 的研发为此领域的研究注入了新的活力,该药物是一种酪氨酸激酶抑制剂,可诱导靶标 BCR-Abl 激酶发生结构重组。 这引发了关于处理激酶抑制的创新理念,包括在 ATP 位点外部结合和尝试防止激酶活化。
详细的酶动力学研究在基于新颖理念表征化合物作用机制中起着不可或缺的作用。 一种具有极高价值的方法是等温滴定量热法 (ITC),该方法可提供化合物与靶蛋白结合的完整热力学资料。 使用该方法产生的数据可对比化合物与不同形式的酶结合的亲和力测定,例如游离酶、酶-底物复合物、酶-产物复合物、活性和非活性酶。
酶信号传导抑制在肿瘤和炎症领域是久经考验的疾病治疗方法。 我们已经知道,ITC 可提供信息确定其他配体是否对酶的生物活性有影响,因此本应用报告主要阐述了 ITC 如何应用于鉴定可赋予这一生物活性的酶的分子间复合物。
等温滴定量热法可在一次实验中测定结合作用的很多个特性,包括亲和力 (KD)、配体结合位点的数量 (n) 以及结合反应的焓 (∆H)。 该方法速度很快,不需要荧光标记,且可用于研究没有催化活性的蛋白质(这些蛋白质因催化活性的缺失而被排除在酶动力学分析的研究之外)。
ITC 实验通常涉及在恒定温度下对靶蛋白滴定实验化合物,使用 ITC 仪器测定结合活动期间释放或吸收的热量。 在针对蛋白激酶的药物研发期间可以多种途径使用此方法。
其中包括:
蛋白质结构表征和制备,不仅仅是模型配体正确的亲和力方面,还包括正确的化学计量,从而帮助评估功能蛋白质的量,而无需催化活性
分析评价
鉴定可赋予生物活性的分子间复合物,ITC 可提供信息来确定其他配体是否会对试验化合物的生物活性产生影响,这正是本应用报告关注的焦点。
在进行机理研究前,对靶蛋白进行质量控制检查即使不是必须的,也是非常有用的。 应通过验证蛋白质的特性、纯度、浓度、功能性和稳定性进行质量控制。
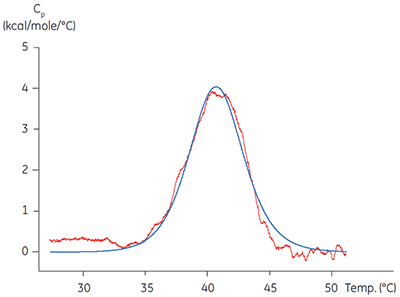
在其中两个重要领域可使用量热法。 ITC 被用于通过对比滴定已知配体获得的亲和力和化学计量与一系列靶蛋白文献数据验证靶蛋白的功能性。 与之相关的差示扫描量热法 (DSC) 技术被用于验证蛋白质的熔解温度,Tm ,远高于实验温度。 分离的激酶域常常只有部分稳定,Tm 值约为 40°C(图 1)。 从长远来看,在开始详细机理研究前使用这些方法来表征靶蛋白可节省时间和成本,有助于避免因蛋白质质量差产生不真实或具有误导性的结果。 激酶域的熔解温度低可能指示稳定性低,突出了对改善纯化标准、储存或分析条件的需求。
|
有关其他配体是否对试验化合物生物活性有影响的信息对于药物研发非常重要。 第二配体可能:对试验化合物的活性没有影响;直接或间接与化合物的结合竞争;或者试验化合物发挥功效需要此配体。
了解试验化合物的作用机制对解释或预测底物浓度与测定 IC50 值所用浓度不同时细胞的活性非常有用。 这还有助于了解 3D 结构的相关性,对于不同的分子间复合物可解析其 3D 结构。 有关作用机制的信息还可用于设计以特定分子间复合物为靶标的后续分析。 激酶抑制剂倾向于结合或诱导激酶蛋白质的非活性构象。 对比各个形式的试验化合物的结合亲和力也有助于确定是否要继续研发与活性或非活性形式的蛋白质结合的化合物。 这种类型的决策将影响后面涉及激酶药物研发的工艺。
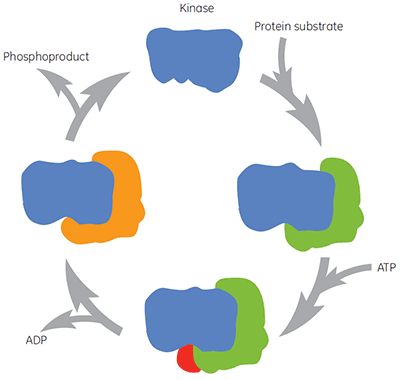
与所有在治疗上非常重要的酶一样,激酶不仅仅是化合物干预的单分子靶标。 在催化循环期间,激酶会结合蛋白质底物、ATP、中间物和产物(图 2)。 这些不同形式的酶也可能存在于很多不同的构象中。 所以,化合物可能指向不同形式的酶且不同的生化检验可能偏向不同形式的酶。 ATP 的生理浓度约为 2 mM,这表示 ATP 能够(通常非常有效地)与在 ATP 位点结合的化合物竞争。 因此,寻找可在 ATP 之前或之后结合的化合物(称作非竞争性化合物)或仅在 ATP 之后结合的化合物(称作抗竞争性化合物)对于激酶药物研发而言都是非常有吸引力的途径。 然而,很多历史悠久的激酶抑制剂都以酶的 ATP 位点为靶标,且预计在与酶结合时会和 ATP 竞争。 其他化合物可能以变构位点为靶标,预计不会与 ATP 竞争。 表征化合物的作用机制可以确定 ATP 或蛋白质底物的存在,对试验化合物亲和力的影响是提高、降低还是没有影响。 研究这种性质有助于了解分子水平的结构-活性关系 (SAR),其同时也是寻找新型药效的关键。
|
酶动力学检测法通常不是为了反应途径上发生的特定的酶形式而设计。 因此关于最大亲和力的相关酶形式的信息有时候很难直接获得。 ITC 通过测量对不同的预设酶形式的结合亲和力可以克服这个限制。 结合游离酶是最简单的方法,但是根据催化机制可以安排 ITC 条件以探测其他酶形式,例如酶-蛋白底物、酶-ATP、酶-ADP 或酶-磷酸化产物复合物。 非可水解 ATP 类似物的使用在探测结合酶与两种底物的三元复合物的潜在化合物中也非常有用。
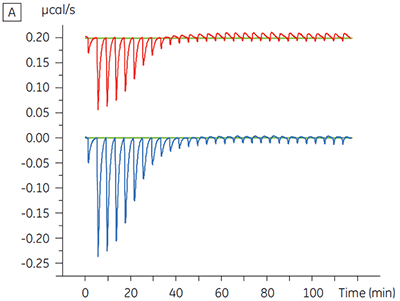
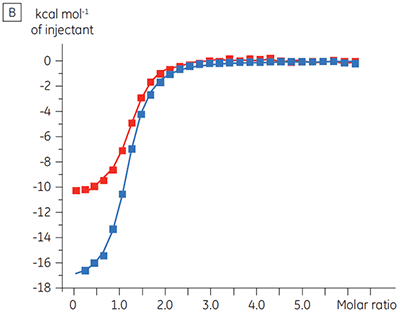
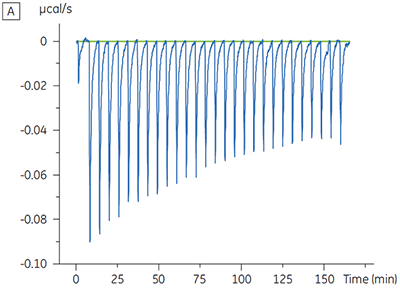
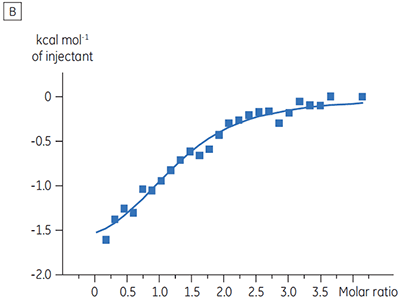
对某种蛋白激酶靶标进行了关于表征 ATP 对试验化合物结合的影响的实验。 对于一种试验化合物在存在和不存在 100μM ATP 时使用 Malvern MicroCal™ VP-ITC 进行 ITC 滴定,对于 ATP 代表大约 60 × KD(图 3)。
|
|
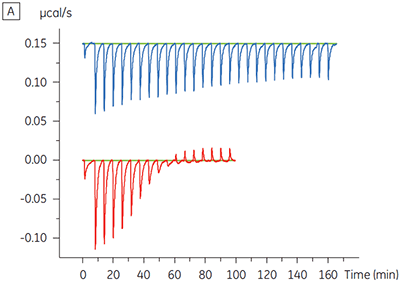
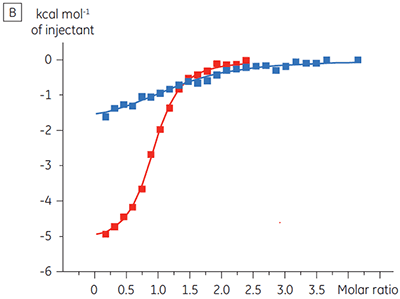
ITC 结果清楚地显示,当检测池中的蛋白样品包含 ATP 时,化合物结合激酶的亲和力没有变化。 焓值指示尽管对亲和力没有影响,但是对结合的焓有显著影响。 因此这些结果表明,该化合物在 ATP 结合方面是非竞争性的,而在存在 ATP 时结合模式可能有些变化。 这不仅强调了 ITC 在表征化合物结合的详细机制中是有用的,而且突出了这种技术在亲和力和结合焓测量中的双探测性质。 在一个类似实验中,对于与相同蛋白质激酶结合的不同试验化合物,观察到其在 ATP 方面的抗竞争动力学。 在不存在 ATP 时 KD 值大于 50 μM(在标准 ITC 试验中是不可测量的),而在存在 ATP 时 Kd 测量值为 0.7 μM (图 4)。
|
|
另一个实验也显示了能够直接监测与单个蛋白质复合物结合的优点,在这里我们猜想化合物对一个信号通路中的两个相邻激酶的复合物有高亲和力。 ITC 允许要研究的化合物单独结合上游激酶,也可以结合上游和下游激酶的复合物,前提是先证明的确形成了该复合物。 对于化合物与复合物的结合,经证实亲和力有 5 倍的增加(图 5)。
|
|
量热法已经被证明在蛋白质激酶抑制研究中具有十分宝贵价值。 该方法可以促进靶蛋白的质量控制检查以及有助于抑制剂结合机制的详细研究。
高通量和自动化仪器的出现为这些应用增加了价值,例如 Malvern MicroCal Auto-iTC200 和 Malvern MicroCal VP-Capillary DSC 系统。 而向更少的试剂消耗方向的努力将确保量热法广泛应用在合理的药物设计过程中。
Geoff Holdgate,Astra Zeneca Pharmaceuticals(英国麦克尔斯菲尔德阿尔德利公园梅勒塞德,SK10 4TG)全球化合物科学、先导物生成-研发能力与科学部门首席科学家