在本应用报告中,我们讨论如何利用纳米颗粒跟踪分析(NTA)技术来测定用于药物输送(如脂质体)的纳米颗粒的粒度和浓度,以确定摄取、降解和从身体清除的速度。
纳米颗粒在药物输送中的应用持续迅猛发展。 纳米颗粒可提供优良的药代动力学特性、长效和缓释以及特定细胞、组织或器官的靶定。 可利用的能用于疾病治疗的新生物活性化合物的发现速度在不断递减,这推动了人们对纳米颗粒药物输送的关注。 每年进入市场的新药越来越少,利用纳米颗粒的多用途和多功能结构进行药物输送的兴趣正在迅速增长。 所有这些特性都能够改善现有药物的疗治效果(Malam 等人,2011年)。
用于药物输送的纳米颗粒已经被定义为亚微米级胶体系统,可以由各种组分中的各种物质构成。 通常定义的纳米颗粒载体包括:脂质体、胶束、超支化高分子、固体脂质纳米颗粒、金属纳米颗粒、半导体纳米颗粒和聚合物纳米颗粒。 多种形式的纳米颗粒已被广泛用于将药物、基因、疫苗和诊断器械送入特定的细胞/组织。 (Ram 等人,2011年)。
考虑一个纳米材料药物输送系统时,纳米颗粒的粒度是一个关键参数,因为它会直接影响输送、摄取、降解和从身体清除的过程。 例如,30 nm至几百nm直径的纳米颗粒能够因为血管渗漏而被动地聚集在肿瘤部位,吞噬作用只对大于500 nm的颗粒有效,而胆清除和肾清除分别发生在颗粒小于30 nm和小于8 nm时。 此外,肝对较小的颗粒(25 nm和50 nm)的摄取率比对较大颗粒(200 nm和300 nm)的摄取率低。 因此,受控颗粒的精确测定对于许多系统和过程都是必要的。
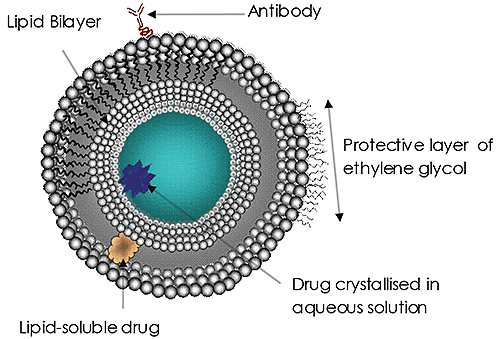
脂质体(图1)多年以来一直是重大研究和开发工作的主体,是目前最常见的靶向给药系统。 脂质体已被批准作为真菌或原虫感染两性霉素B、乳腺癌治疗的多柔比星和甲肝及流感疫苗的输送系统。 脂质体在药物输送中的应用和潜力的重要性在不断增长。 理由很明显:
所用脂质体的大小越来越多地被认为是疗效的一个重要因素。 药物输送脂质体的大小可能影响其在血液中的循环和停留时间、靶定的有效性、其细胞吸收(或内吞)的速度以及其有效载荷的成功释放。 这类尺寸因素对于所有纳米级药物输送系统都非常重要。
|
马尔文的NanoSight仪器系列可准确、快速地对水和其他溶剂中的脂质体进行测定大小和计数。 只需要少量样品和非常少的样品制备工作。 仪器让我们能够观察到悬浮液中单个的脂质体并跟踪其布朗运动,几秒钟就可以建立基于单个颗粒的粒度分布。
|
除大小和浓度外,NTA还提供以下参数,无论是同时还是逐粒:
聚(β-氨基酯)(PBAE)是基因疗法用于治疗各种癌症的潜在输药系统。 它们较某些其他通过组合方式进行聚合物与DNA的多种组合的系统更具优势。 它们还因为水解降解作用而具有快速释放的特性,但这对于配料、生产和储存都构成了挑战。 冷冻干燥是一种典型的储存方法,NTA已被用来评估冷冻干燥对聚合的影响(尺寸增加)和对PBAE-DNA纳米颗粒的破坏(尺寸减小)(Tzeng 等人 2011年和Sunshine 等人。 2012年)。
聚(乳酸-共-乙醇酸)(PLGA)是一种FDA批准的药物输送系统。 它分解成乳酸和乙醇酸,二者皆为代谢途径在人体内的终点。 PLGA已被用作阿莫西林的药物输送系统,也用于促性腺激素释放激素进行晚期前列腺癌的治疗。 免疫抑制剂霉酚酸已经被封装于PLGA中,以降低剂量,从而减小毒副作用。 NTA被用来确定这些纳米颗粒的大小,它是确保顺利输送和让研究人员比较各研究结果的一个关键参数(Shirali 等人 2011年)。
分子在整个细胞膜内的顺利输送是药物输送的一个关键点。 在许多情况下,分子本身并不能渗透细胞膜,因此,需要一个高效的载体。 Sokolova 等人 (2012年)已经应用包括NTA、动态光散射(DLS)和电子显微镜法(EM)在内的许多技术研究了磷酸钙纳米颗粒(直径:100 nm~250 nm,取决于功能)作为小分子和大分子在细胞膜内的多功能载体。
Ohlsson 等人 (2012年)报告了溶质在不到100毫秒的时间内运移过单个蛋白质体的脂质双层膜,利用NTA来检查质体的稳定性和完整性。
在纳米颗粒作为基因载体的研究中,Ghonaim及其同事们广泛报告了将NTA用于其修改各种不同的非病毒质粒DNA和siRNA输送系统中脂多胺和精胺的化学组成的影响的研究(Ghonaim 等人,2007a;Ghonaim 等人,2007b;Ghonaim 等人,2007c;Ghonaim,2008年;Ghonaim 等人,2009年;Soltan 等人,2009年;Ghonaim 等人,2010年)。 同样,Ofek 等人(2010年)已经用NTA进行siRNA输送树状纳米载体的鉴定,而Bhise在研究细胞培养基中的基因输送聚合物过程中测定了粒度和粒度分布(Bhise 等人, 2010年)。 最近,Bhise进一步扩展了该工程,以开发一种量化由聚合物纳米颗粒封装的质粒数量的测定法,其中他利用NTA技术确定每100 nm纳米颗粒的数密度(Bhise 等人, 2011年)。
Wei 等人 (2012年),在探索纳米医学进步带来的挑战和机遇时,确定了需要稳健的方法对纳米颗粒大小、形状和组成以及颗粒工程的表征,以维持低水平的非特异性细胞毒性和增加储存过程中的稳定性。
其他有关测定大小的重要性以及用NTA列举纳米药物输送系统的实例已经得到了报道(Hsu 等人, 2010年; Park 等人, 2010年; Tagalakis 等人, 2010年)。
1. Bhise NS, Gray RS, Sunshine JC, Htet S, Ewald AJ and Green JJ (2010) The relationship between terminal functionalization and molecular weight of a gene delivery polymer and transfection efficacy in mammary epithelial 2-D cultures and 3-D organotypic cultures, Biomaterials, doi:10.1016/j.biomaterials.2010.07.023
2. Bhise NS, Shmueli RB, Gonzalez J and Green JJ (2011), A Novel Assay for Quantifying the Number of Plasmids Encapsulated by Polymer Nanoparticles. Small. doi: 10.1002/smll.201101718
3. Ghonaim HM, (2008) Design and Development of Pharmaceutical Dosage Forms for Gene and siRNA Delivery, PhD Thesis University of Bath, Department of Pharmacy and Pharmacology, September 2008
4. Ghonaim HM, Li S and Blagbrough IS (2010) N1,N12-Diacyl Spermines: SAR Studies on Non-viral Lipopolyamine Vectors for Plasmid DNA and siRNA Formulation Pharmaceutical Research, Vol 27, (1) p17-29
5. Ghonaim HM, Li S, Soltan MK, Pourzand C and Blagbrough IS (2007a), Chain Length Modulation in Symmetrical Lipopolyamines and the effect on Nanoparticle Formulations for Gene Delivery, in British Pharmaceutical Conference BPC2007, Manchester, 10th Sept.
6. Ghonaim HM, Li S, Pourzand C and Blagbrough IS (2007b), Efficient Novel Unsymmetrical Lipopolyamine Formulations for Gene Delivery, in British Pharmaceutical Conference BPC2007, Manchester, 10th Sept.
7. Ghonaim H M, Li S, Pourzand C and Blagbrough IS (2007c), Formulation and Delivery of Fluorescent siRNA by Lipospermine Nanoparticle Complex Formation, in British Pharmaceutical Conference BPC2007, Manchester, 10th Sept.
8. Ghonaim H, Li S and Blagbrough IS (2009) Very Long Chain N4 , N9 -Diacyl Spermines: Non-Viral Lipopolyamine Vectors for Efficient Plasmid DNA and siRNA Delivery Pharmaceutical Research, Volume 26, Number 1, p19-31
9. Hsu J, Serrano D, Bhowmick T, Kumar K, Shen Y, Kuo Y C, Garnacho C and Muro S (2010) Enhanced Endothelial Delivery and Biochemical Effects of α-Galactosidase by ICAM-1-Targeted Nanocarriers for Fabry Disease Journal of Controlled Release, Article in Press, doi:10.1016/j.jconrel.2010.10.031
10. Malam Y, Lim E and Seifalian A (2011) Current trnds in application of nanoparticles in drug delivery, Current Medicinal Chemistry, Volume 18, Number 7, March 2011, pp.1067-1078 (12)
11. Ofek P, Fischer W, Calderon M, Haag R and Satchi-Fainaro R (2010) In vivo delivery of small interfering RNA to tumors and their vasculature by novel dendritic nanocarriers. FASEB J..doi 10:1096/fj.09-14964
12. Ohlsson G, Tabaei S, Beech JP, Kvassman J, Johansson U, Kjellbom P , Tegenfeldt JO and Höök F(2012) Solute transport on the sub 100 ms scale across the lipid bilayer membrane of individual proteoliposomes, Lab Chip, 2012, Accepted Manuscript, DOI: 10.1039/C2LC40518K
13. Park J, Gao W, Whiston R, Strom T, Metcalfe S and Fahmy TM (2010) Modulation of CD4+ T Lymphocyte Lineage Outcomes with Targeted, Nanoparticle-Mediated Cytokine Delivery, Mol. Pharmaceutics, 2011, 8 (1), pp 143-152
14. Ram M, Yaduvanshi KS, Yadav H, Singh N, Mangla G, Shivakumar H (2011) Nanoparticles, Promising Carriers in Drug Targeting: A review current drug therapy, Volume 6, Number 2, May 2011, pp.87-96(10)
15. Reshetov et al, Photochem Photobiol. 2012 Sep-Oct;88(5):1256-64. doi: 10.1111/j.1751-1097.2012.01176.x).
16. Shirali, et al. Am J Transplantation. 2011; 11: 2582-2592
17. Sokolova V, Rotan O, Klesing J, Nalbant P, Buer J, Knuschke T, Westendorf AM and Epple M (2012) Calcium phosphate nanoparticles as versatile carrier for small and large molecules across cell membranes, Journal of Nanoparticle Research, Volume 14, Number 6 (2012), 910, DOI: 10.1007/s11051-012-0910-9
18. Soltan MK, Ghonaim HM, El Sadek M, Kull MA, El-aziz LA and Blagbrough IS (2009) Design and Synthesis of N4, N9-Disubstituted Spermines for Non-viral siRNA Delivery - Structure-Activity Relationship Studies of siFection Efficiency Versus Toxicity, Pharmaceutical Research, Volume 26, Number 2, p 286-295
19. Sunshine et al. PLoS ONE, 2012; 7(5):e37543. doi:10.1371 /journal. Pone .0037543
20. Tagalakis A D, Grosse S M, Meng Q-H, Mustapa M F M, Kwok A, Salehi S E, Tabor A B, Hailes H C and Hart S L (2010) Integrin-targeted nanocomplexes for tumour specific delivery and therapy by systemic administration, Biomaterials, Vol 32, Issue 5, February 2011, p1370-6
21. Tzeng et al. Biomaterials. 2011 August; 32(23): 5402-5410. doi:10.1016/j.biomaterials.2011.04.016
22. Wei A, Mehtala JG and Patri AK (2012) Challenges and opportunities in the advancement of nanomedicines, Journal of Controlled Release, http://dx.doi.org /10.1016/j.jconrel.2012.10.007