溶液中蛋白质的物理性质和行为取决于与蛋白质的纯化和构成及其自身固有属性相关的多种因素。 尺寸排阻色谱 (SEC) 是一种强大的工具,常用于分析蛋白质的回收率、分子量和聚集性。
SEC 的工作原理涉及在样品流经多孔的惰性色谱柱基质时对样品进行分离。 较小的分子进入填料孔内,而较大的分子则被排除在外,因此可更快速地通过色谱柱。 结果是获得基于流体力学体积的分离,但是人们通常要求得出分子量。 以前,通过比较未知蛋白质与(已知分子量的)标准球状蛋白质的洗脱时间估算分子量,我们把这一过程称为“传统校正法”。 通常使用诸如紫外 (UV) 等单一的浓度检测器完成上述操作。 然而,现在我们联合使用光散射检测器和浓度检测器(紫外或折光率,RI),可不依赖保留时间测定蛋白质分子量。 这一进步非常有用,因为许多蛋白质不具有球状结构,使得它们测得的分子量不准确。 由于增加了更多检测器(如另一台浓度检测器)、特性粘度 (IV) 和动态光散射 (DLS) 检测,可极大地增加单次 SEC 测定所获得的信息量。
Malvern SEC-MALS 20(图 1)系统是一款 20 角度光散射设备,能够不依赖于洗脱体积测定蛋白质分子量。 在此应用说明中,一些蛋白质使用 SEC 进行分离。 使用多角光散射 (MALS) 或传统校正法测定它们的分子量, 并讨论了这些结果的差异。
|
将 SEC-MALS 20 系统连接至使用 TDA RI 检测器的 Viscotek TDAmax 系统以测定浓度。 样品沿 2 根 Viscotek 蛋白柱以磷酸盐缓冲液作为流动相进行分离。 所有蛋白质样品均溶解在流动相中。 使用牛血清白蛋白(一种分子量表征良好的蛋白质)校准 SEC-MALS 20 系统。 使用一系列球状蛋白质(用于分子量为 29,000-700,000 Da 的蛋白质的凝胶过滤标记物试剂盒,Sigma-Aldrich)进行色谱柱校正。
该检测器和色谱柱均置于 30°C 环境下,以确保良好的分离效果和最佳的检测器基线稳定性。
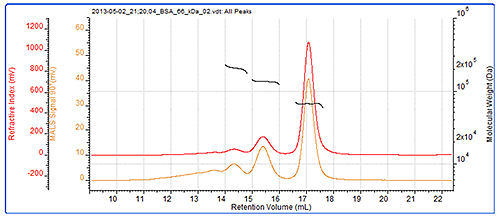
作为系统验证,应经常检查校准品,而 BSA 二聚体(通常存在于 BSA 样品中)是一种极好的检验标准品。 这种情况下,已正确测定二聚体的分子量,并对样品中存在的三聚体进行了精确测定。 BSA 色谱图见图 2,而 BSA 测定的结果见表 1。 图 2 也显示了 BSA 的 SEC-MALS 色谱图。 作为一种各向同性散射体,BSA 的峰大小和检测器响应在各角度均相同。 可清楚地看到各峰的分子量均非常稳定。 这种情况预计出现在分子量受到严格控制并被认为具有单分散性的蛋白质中。 上述结果和分子量数值表明这些峰是 BSA 的不同寡聚体。
|
|
| 三聚体 | 二聚体 | 单体 | |
|---|---|---|---|
| RV 峰 - (ml) | 14.31 | 15.37 | 17.05 |
| Mn - (kDa) | 203.8 | 135.2 | 66.4 |
| Mw - (kDa) | 204.4 | 135.3 | 66.5 |
| Mw/Mn | 1.003 | 1.001 | 1.001 |
| Wt Fr(峰) | 0.054 | 0.165 | 0.78 |
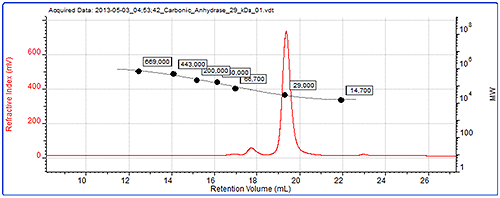
图 4 显示了传统校正法的数据。 色谱图显示了碳酸酐酶(一种标准品)的折光率信号和生成的校正曲线。
|
采用传统校正法测定 BSA 二聚体和三聚体的分子量,结果见表 2,可与表 1 中的 SEC-MALS 数据进行比较。 由于这些寡聚体的结构不再像单体那样是球状的,因此使用色谱柱校正法无法准确计算它们的分子量。 不使用光散射的情况下,无法得知使用色谱柱校正法测得的分子量是否准确。 同样地,这些峰可能被错误地鉴定为三聚体和五聚体。 但是,可通过精确地测定其分子量,使用光散射结果(表 1)正确地鉴定二聚体和三聚体。
| 三聚体 | 二聚体 | |
|---|---|---|
| RV 峰 - (ml) | 14.32 | 15.33 |
| Mn - (kDa) | 341.1 | 198.4 |
| Mw - (kDa) | 345.1 | 202.2 |
| Mw/Mn | 1.012 | 1.019 |
| Wt Fr(峰) | 0.021 | 0.103 |
最后,使用 SEC-MALS 和色谱柱校正法测定了另一种蛋白质(胃蛋白酶)的分子量。 色谱图和光散射结果见图 5。 表 3 显示了测得分子量的比较结果。
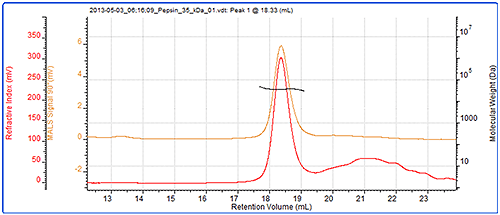
|
| MALS | 色谱柱校正法 | |
|---|---|---|
| RV 峰 - (ml) | 18.33 | 18.63 |
| Mn - (kDa) | 34.6 | 38.5 |
| Mw - (kDa) | 34.7 | 39.6 |
| Mw/Mn | 1.004 | 1.028 |
使用 SEC-MALS 正确测得胃蛋白酶的分子量为 35 kDa,而使用色谱柱校正法却错误地测得分子量为 40 kDa。 造成这种结果的原因是胃蛋白酶的结构不是球状,因此比预计为球状蛋白质时的分子量大。 因此,它的洗脱时间较早,而且通过传统校正法记录的分子量比正确值略高。 另一方面,来自光散射的分子量不依赖于洗脱体积,因此可正确测量。
此应用说明表明,使用 Malvern SEC-MALS 20 系统可成功测定一些蛋白质的分子量。 将 MALS 添加至 SEC 系统可实现蛋白质分子量的测定,不依赖于蛋白质的洗脱体积或结构。 使用 SEC-MALS 系统可以正确测量胃蛋白酶和 BSA 寡聚体的分子量,从而实现良好的表征。