合规性在制药行业中至关重要。 现行法规旨在确保只有以明确且可追溯的方式生产的安全有效的产品才能到达消费者手中。 但是,确保遵守这些准则往往费时费力。 制药公司必须应对复杂的监管体系,包括 21 CFR 第 11 部分要求、数据完整性指南 (ALCOA++) 以及概述了分析仪器确认的整个过程的 USP <1058>。
良好规范 (GxP) 法规(包括良好生产规范 (GMP/ICH Q7) 要求)构成了有关此问题的框架。 必须使用安装鉴定和操作鉴定 (IQ/OQ) 程序和文档,根据客户的用户要求规范 (URS) 对仪器进行鉴定。 然后,客户必须执行定期测试,并将此纳入持续绩效评估 (PQ) 计划的一部分。
面临哪些合规性挑战?
如今,在经过验证/受监管的环境中执行测量需要比以往更加小心。 除了符合 21 CFR 第 11 部分的要求外,还要求考虑测量数据的完整性 (ALCOA++),包括数据的长期存储/可访问性以及分析仪器本身的认证。 在某些情况下,检查和批准测量结果所需的时间可能会超过样品处理时间。 这是开发和生产安全药品必须具备的必要框架的一部分。 我们的软件(包括 OmniTrust 软件包)支持(通过适当的本地 IT 基础设施)21 CFR 第 11 部分合规性和 ALCOA++ 数据完整性指南。 然后通过相关监管机构的定期监督审核来测试这种合规性。
马尔文帕纳科能提供哪些帮助?
凭借多年在监管环境中应用的仪器认证和软件开发的经验,我们在这一领域积累了丰富的知识。 除了为我们的产品提供必需的综合IQ/OQ外,我们还:
- 提供性能认证 (PQ) 的标准
- 提供测试脚本以验证21 CFR 第 11 部分和您系统上的数据完整性功能
- 提供功能丰富的软件,可用作 21 CFR 第 11 部分和/或数据完整性兼容解决方案的一部分
- 可根据您的定制验证需求提供咨询服务,就 GMP/ICH Q7 药物认证提供建议,并为您提供其他疑问解答或需求支持
USP <1058>:分析仪器确认
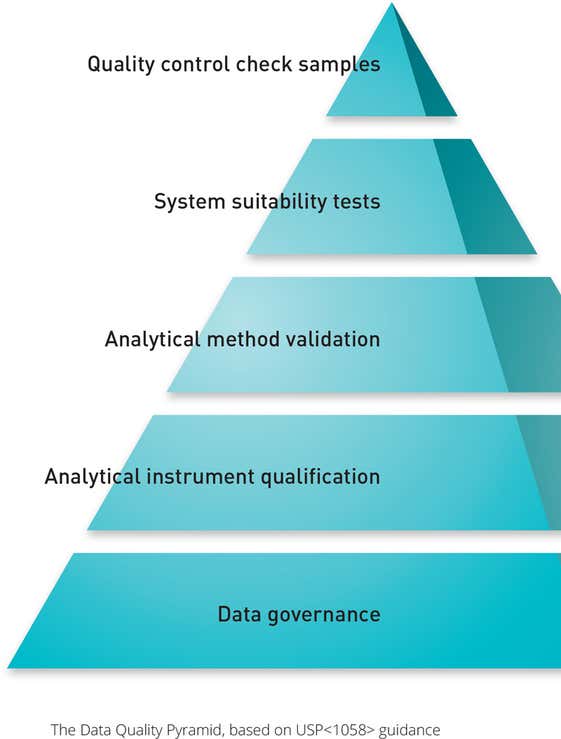
USP <1058> 中详述的规范要求强调了 IQ/OQ 在验证过程中的重要性。 这些程序现在直接与仪器的原始用户要求规范 (URS) 及其性能认证 (PQ) 和性能验证 (PV) 相关联。
操作认证(OQ)现在还必须测试仪器是否适合最终用户的应用,以及是否按照制造商设计的那样工作。
马尔文帕纳科为此提供了一个全面的 IQ/OQ 包,我们也很乐意就您的其他测试需求为您提供咨询。
适用于受监管环境的软件
审核测量数据往往很费时,因此我们提供功能丰富的软件,以帮助我们的客户更高效地完成此过程。 其设计简单但功能强大,节省了实施和日常使用的时间,简化了工作流程,并确保在审核期间不会发现任何意外,让您完全放心。 这构成了符合 21 CFR 第 11 部分标准的解决方案的一部分(结合稳健的 IT 策略)。
主要软件功能包括:
- 支持用户设置不同角色
- 签署测量结果的审批流程
- 记录中止测量的原因
- 捕获由于使用不正确凭据而导致的失败操作的审核跟踪条目
- 审核远程查看的安全功能
 下载 OmniTrust 手册:马尔文帕纳科针对受监管环境的合规性解决方案
下载 OmniTrust 手册:马尔文帕纳科针对受监管环境的合规性解决方案
合规性服务
标准
我们为您的所有验证需求提供了各种参考和校准标准。
IQ/OQ 和其他测试脚本
我们的客户支持团队可以执行 IQ/OQ 服务并提供验证测试脚本,以验证软件的 21 CFR 第 11 部分和数据完整性功能。
验证服务
我们始终欢迎客户与我们交流其他验证要求。
我们提供的软件(包括 OmniTrust 软件包)适用于受监管环境,这得益于诸如审计跟踪、电子签名和分层访问权限等功能。
精选内容