리포좀은 기본 특성을 원하는 특성(지질 조성, 농도, 수분 함량, 매질(다양한 완충액, 가변성 이온 강도, pH 등)과 층상구조(단층, 대형 또는 소형(대형 단층 소포, LUV 및 소형 단층 소포, SUV), 다층 소포, MLV))에 맞게 쉽게 변경할 수 있기 때문에 모델 막 및 약물 투여에서 널리 사용됩니다. 이러한 연구에서는 순수 리포좀과 함께 다른 분자(단백질, 펩타이드, 약물)와의 혼합물을 특성화하여 리포좀 상 거동에서 추가된 성분의 영향을 확인해야 합니다.
DSC는 막 거동 특성화에 대한 기본 기법으로 온도 유도 전이에 대한 모든 열역학 파라미터를 제공합니다. 또한 다른 성분(약물, 단백질, 펩타이드, 고분자 등)과 막의 혼합물의 경우 DSC는 막 거동에 대한 추가된 성분의 효과에 관한 정보를 제공하는 일선 스크리닝 방법을 나타냅니다.
지질은 세포막의 기본 성분으로서 단백질과 다른 성분들이 통합되거나 결합되는 표면의 안이나 겉에 지질 이중층을 형성합니다[1-4]. 생물학적 막이 올바르게 기능하기 위해서는 주로 유체인 환경이 필요하지만, 단백질 삽입 및 기능과 관련된 막 구획화(예: 액체 질서 상이 존재하는 플라즈마 막의 지질 뗏목 영역[5,6 ]
지질이 물과 접촉하면 친액성 상이 실온에서 자발적으로 형성되거나 액체-결정상으로의 전이 온도를 넘는 더 높은 온도에서 현탁액을 초음파 처리하거나 보텍스 처리해야 합니다. 농도 및/또는 온도가 변하면 다른 상이 발생할 수 있다는 것은 일찍이 알려졌습니다 친액성 및 열방성 메조모르피즘이라고 하는 과정입니다[1]. 그러면 인지질이 다층, 소형 올리고층 또는 단층 소포의 형태로 친액성 층상을 형성합니다. 그 다음에 온도가 변하면 여러 가지 층상 유형 간에 온도 유도 전이가 발생할 수도 있고 역상 헥사고날 또는 복연속 입방상과 같은 친액성 상이 추가로 나타날 수 있습니다[7].
리포좀은 기본 특성을 원하는 특성(지질 조성, 농도, 수분 함량, 매질(다양한 완충액, 가변성 이온 강도, pH 등)과 층상구조(단층, 대형 또는 소형(대형 단층 소포, LUV 및 소형 단층 소포, SUV), 다층 소포, MLV))에 맞게 쉽게 변경할 수 있기 때문에 모델 막 및 약물 투여[6,9-19]에서 널리 사용됩니다. 이러한 연구에서는 순수 리포좀과 함께 다른 분자(단백질, 펩타이드, 약물)와의 혼합물을 특성화하여 리포좀 상 거동에서 추가된 성분의 영향을 확인해야 합니다[6,20-26].
순수 지질 및 순수 지질과 다른 성분과의 혼합물로 구성된 막에 대한 친액성 지질 상에서 열방성 상 전이를 결정하는 이상적인 실험 기법은 시차 주사 열량측정법(DSC)[24,27]입니다. 따라서 이 기법은 이 목적으로 널리 사용되며 일부 검토 논문[6,32-35]을 포함하여 중요한 데이터를 문헌[13,28-31]에서 사용할 수 있습니다.
대부분의 연구는 높은 재현성으로 가장 쉽게 결정할 수 있는 특성인 전이 온도에만 초점을 맞추고 있습니다. 그렇지만 적절한 제제 프로토콜을 사용하면 현재 DSC 기기로 엔탈피가 높은 전이(층상 전이)에 대하여 우수한 정밀도와 재현성으로 전이 엔탈피를 구할 수도 있습니다. 대부분의 지질에서 주요 전이는 겔(Lb')에서 액체 결정상(La)으로 발생합니다. 이것은 빠르고 가역성이 높은 전이이며 탄화수소 체인과 고 엔탈피 DSC 피크의 협력형 용융이 특징입니다. 포스파티딜콜린에서 평면 겔(Lb')에서 리플상(Pb’)으로 가는 소위 사전 전이는 엔탈피가 낮으며 시료 제제 및 불순물의 존재에 매우 민감합니다. 그래도 쉽게 구할 수 있는 경우가 많지만, 스캔 속도에 더욱 민감하여 스캔 속도가 낮으면 전이 온도가 낮아진다는 점을 강조해야 합니다(그림 1).
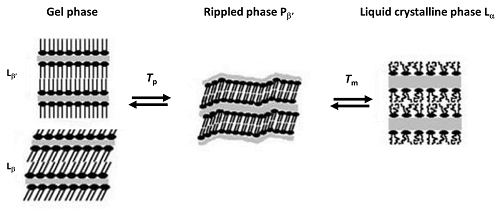
그림 1. 포스파티딜콜린의 리포좀에서의 사전(Tp) 및 주요(Tm) 전이(Koynova 및 Caffrey, 1998b를 적절하게 수정[31])
액체 결정상(La)에서 육각상(H)으로의 전이는 포스파티딜에탄올아민에서 흔히 나타나며 엔탈피가 훨씬 낮지만 충분히 높은 농도에서는 고감도 DSC 기기로 측정할 수도 있습니다. 특정 실험 조건에서 관찰되는 추가 전이가 있지만 이 응용 노트에서는 다루지 않습니다.
리포좀을 모델 막으로 사용할 때 추가된 성분이 리포좀 거동에 미치는 효과를 관찰하여 작용 메커니즘의 기본적인 측면을 밝히는 것이 목표입니다. 반면에 리포좀을 약물 전달체로 사용하는 경우 약물 로딩 시 거동 변화, 약물 통합 방법, pH 또는 기타 변수에 대한 의존성 등을 모두 확인하고 특성화해야 합니다. 이러한 모든 연구에서 DSC는 대량 작용에 대한 신뢰할 수 있고 포괄적인 정보를 제공하는 일선 방법입니다.
이 광범위한 방법론적 연구에서는 DMPC(1,2-디미리스토일-sn-글리세로-3-포스포콜린)를 사용하였습니다. 3:1 몰 혼합물의 DMPC 및 DMPG(1,2-디미리스토일-sn-글리세로-3-[포스포rac-(1-글리세롤)]) 혼합물에 대해서도 상호 보완적 데이터를 제공합니다. 이것은 이상에 가까운 혼화성 및 거동을 가진 지질 혼합물의 예로 선택되었으며, POPE 및 POPG(각각 1-팔미토일-2-올레오일-sn-글리세로-3-포스포에탄올아민 및 1-팔미토일-2-올레오일-sn-글리세로-3-포스포-(1'-rac-글리세롤))는 역시 3:1 몰 혼합물에서 사용되며 두드러진 비이상적인 거동이 있는 지질 혼합물의 예로 선택되었습니다.
재현 가능한 결과를 얻으려면 엄격한 제제 프로토콜을 따라야 합니다. 제제 세부 사항은 사용자에 따라 다르지만 주요 단계는 다음과 같습니다.
대부분의 제제 방법에서 리포좀은 처음에는 MLV로 획득됩니다. 가장 일반적으로 사용되는 제제 방법은 지질 막 방법입니다. 그러나 단일 지질로 구성된 리포좀은 직접 수화를 통해 얻을 수 있습니다.
MLV를 사용할 때는 DSC 분석 전에 8시간 이상 냉장고(4°C)에 보관해야 합니다.
MLV를 사용할 때는 DSC 분석 전에 8시간 이상 냉장고(4°C)에 보관해야 합니다.
대부분의 경우에 LUV는 결과의 높은 재현성을 보장하기 위해 사용하기에 가장 좋은 형태의 리포좀입니다. MLV는 시간이 지나면서 침전하기 때문에 분석할 시료를 피펫으로 옮길 때 극도로 주의해야 합니다. SUV는 곡률이 커서 더 큰 소포로 융합되는 경향이 있기 때문에 시간이 지나면서 불안정해집니다.
LUV는 압출을 이용하여 MLV로부터 준비합니다. 압출기에는 겔에서 액체 결정으로의 전이 온도보다 ~10°C 높은 온도를 유지하는 재순환 수조가 있는 온도 조절 셀이 포함되어 있습니다. 그 다음에는 리포좀 현탁액이 불활성(N2) 대기에서 공극 크기가 감소하는 필터를 통과합니다(600nm, 200nm 및 100nm. 각각 5, 10 및 10회).
제제 후에 지질 시료를 DSC 분석에 사용하기 전에 하룻밤 동안 4°C의 냉장고에 보관합니다.
동적 광산란을 사용하여 소포의 직경을 측정하여 시료 특성화를 완료합니다. 측정을 몇 번 수행하고, 평균 결과를 구하고, 불확실성과 함께 보고합니다(예: 평균의 2x 표준 편차 또는 그 밖에 기술해야 하는 모든 분산 파라미터). 결과 예가 아래의 그림 2에 나와 있습니다. 여기에서 다분산성 지수는 0.1이고, 단일 피크가 나타나며, (강도를 기준으로) 측정한 크기는 146nm ± 8nm로 코릴로그램이 양호하게 나타났습니다.
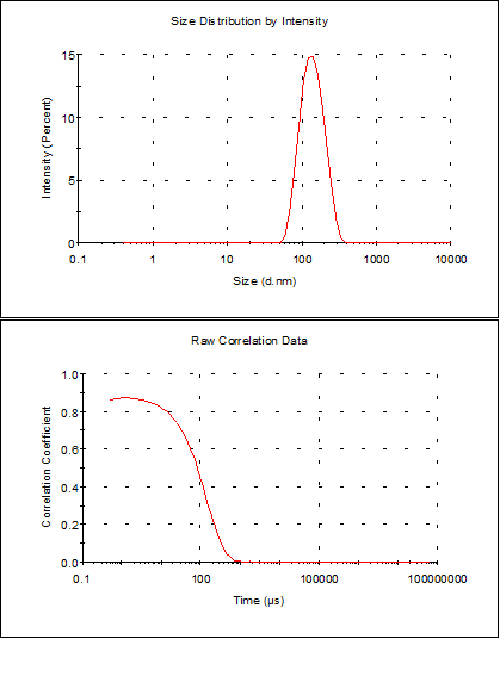
그림 2 압출 후에 HEPES 완충액(10mM HEPES, 150mM NaCl, pH 7.4)에서 DMPC/DMPG 3:1 몰 혼합물의 리포좀 제제에 대하여 DLS로 구한 결과
그 다음에는 인몰리브덴산염 방법[36]을 사용하여 정확한 인지질 농도를 결정합니다. 압출 과정에서 일부 지질(일반적으로 3-5%)이 손실되고 올바른 전이 엔탈피를 보고하기 위해서는 정확한 농도가 필요하기 때문에 엔탈피를 정확하게 계산하기 위해서는 이 과정이 필수적입니다.
모든 경우에 가스를 제거한 완충액을 실험 전날 저녁에 양쪽에서 VP-DSC에 로딩하였고, 기기는 선택한 스캐닝 프로그램(초기 및 최종 온도, 스캔 전후의 대기 시간, 게인, 필터)을 사용하여 하룻밤 동안 스캔하도록 놓아두었습니다. 그 다음에는 이전에 시작 온도보다 ~2°C 낮은 온도에서 가스를 제거한 시료를 획득 프로그램을 중지하지 않고 열량측정계의 시료 격실에 로딩합니다("사이클 중" 로딩).
리포좀 전이는 매우 좁은 온도 간격으로 발생하므로 여기에 사용이 권장되는 게인은 "높음"입니다. 실제로 경우에 따라서는 다양한 게인을 테스트하고 가장 적절한 게인을 사용하는 것이 유용할 수 있습니다. 따라서 모든 실험은 선택한 높은 게인으로 수행되었습니다(게인을 테스트한 일련의 실험은 제외).
실험 후 데이터 분석에는 다음과 같은 사항이 포함되었습니다.
단일 지질의 리포좀의 경우에도 특히 MLV에서의 사전 전이와 관련하여 첫 번째 스캔에서 구한 결과는 다음 결과와 약간 다르다는 점이 일반적으로 관찰됩니다. 따라서 항상 두 번째 이후의 스캔 값을 사용하고 해당 값에서 참조하는 스캔을 보고해야 합니다. DMPC와 함께 지질 혼합물을 사용하여 수행하는 이 연구에서는 항상 두 번째 스캔을 사용하여 보고 값을 계산합니다.
청소는 신뢰할 수 있는 데이터를 얻기 위해 모든 실험 측정에서 기본적인 사항입니다. 채택할 청소 절차는 사용되는 지질, 측정의 길이, 그리고 침전/응집의 존재에 따라 달라집니다. 침전/응집이 발생하지 않고 동일한 시료를 사용하여 광범위한 반복 실행을 하지 않는(즉, 반복이 3 또는 4회를 넘지 않음) 대부분의 측정에서 시료를 제거한 후에 물을 사용하여 셀을 수동으로 15회 이상 세척해야 합니다. 그런 다음 새 시료 로딩을 하기 전에 완충액으로 셀을 플러싱해야 합니다.
침전/응집이 발생하면 세제 또는 질산 용액으로 시료 격실을 세척해야 합니다. 청소제가 로딩되면 원하는 경우 온도를 높여 청소를 개선할 수 있습니다. 최대 10분 후에 시료 격실을 제거하고, 수동으로 광범위하게 세척한 다음(15회 초과), 약 250cm3의 물을 연속으로 흘려보내서 자동으로 세척합니다.
전체 측정 세트(지질의 경우 일반적으로 1주)를 수행한 후에 완전한 세척 절차를 수행하고 시스템에 물을 로딩한 후 하룻밤 동안 기준선 스캔을 실행하도록 놓아두어서 올바르게 청소되었는지 확인해야 합니다.
DMPC를 단일 지질 모델로 사용하여 다양한 실험 조건에 대하여 DSC 결과를 제공합니다.
4(가변성 게인)를 제외한 모든 경우에 여기에서 보고된 값은 높은 게인으로 구한 것입니다.
DMPC의 MLV 및 LUV는 위에서 설명한 대로 HEPES 완충액(10mM HEPES, 150mM NaCl, pH 7.4)을 사용하여 준비하였습니다.
직접 수화(A) 및 지질 막(B) 제제 방법에 대한 그림 3에서 DSC 흔적을 볼 수 있습니다.

그림 3. 직접 수화(A) 및 지질 막(B) 제제 방법을 위한 HEPES 완충액(10mM HEPES, 150mM NaCl, pH 7.4)의 DMPC에서 나온 MLV의 DSC 흔적. 곡선은 스캔 속도: 60°C/시간, 사전 기간: 15분, 게인: 높음, 필터: 10의 조건에서 수행한 실험에서 두 번째 스캔에 해당합니다.
두 프로파일은 동일합니다. 즉, 사전 전이(겔(Lb' 또는 Lb)에서 리플상(Pb’)으로) 및 주요 전이(이 경우에 리플상에서 액체 결정상으로(Pb' 에서 La로))가 분명하게 관찰됩니다.
5개를 넘는 독립 리포좀 제제에서 보고된 오차 범위 내에서 DMPC에 사용된 두 제제 방법의 결과로 나온 열역학 파라미터 간에 중대한 차이는 없는 것으로 나타났습니다.
스캔 속도: 60°C/시간, 사전 기간: 15분, 게인: 높음, 필터 10의 조건을 사용하여 (동일한 제제 및 독립 제제를 합친) 11개 실험에 대하여 평균의 표준 편차의 두 배로 보고된 불확실성과 함께 두 방법(여기에서 첨자 pre는 사전 전이를 나타내고 m은 주요 전이를 나타냄)에 따라 제제한 리포좀에 대한 DSC 분석에서 나온 열역학 파라미터는 다음과 같이 보고됩니다.
T pre = (15.4±0.4)°C ∆Hpre = (4.7±0.3) kJ mol-1
T m = (24.1±0.1)°C ∆Hm = (27.0±0.7) kJ mol-1
T pre = (14.7±0.4)°C ∆Hpre = (3.9±0.2) kJ mol-1
T m = (24.4±0.2)°C ∆Hm = (26.2±0.6) kJ mol-1
MLV에서 지질 이중층이 더 많아서 겔에서 액체 결정으로의 전이에 대한 피크가 훨씬 협력적이기 때문에(즉, 절반 높이에서의 폭(WHH)이 훨씬 작음) MLV와 LUV는 DSC 프로파일이 매우 다르게 나타납니다.
그림 4에는 HEPES 완충액(10mM HEPES, 150mM NaCl, pH 7.4)의 DMPC 리포좀의 3mM 시료에 대한 DSC 흔적(MLV(A)와 LUV(B)로 표시)과 비교를 쉽게 하기 위해 중첩한 곡선 2개가 나와 있습니다.

그림 4 HEPES 완충액(10mM HEPES, 150mM NaCl, pH 7.4)의 DMPC에서 나온 MLV(A) 및 LUV(B)의 DSC 흔적 MLV 및 LUV DSC 흔적(C)의 중첩. 리포좀(MLV)은 막 방법으로 준비하였습니다. 실험 조건은 스캔 속도: 60°C/시간, 사전 기간: 15분, 게인: 높음, 필터: 10이었습니다.
전이의 엔탈피를 계산하기 위해 MLV에 대해 무게를 측정하여 구한 지질 함량과 LUV에 대해 인몰리브덴산염 방법으로 구한 지질 함량을 사용하였습니다. 사전 전이는 일반적으로 LUV에 대해서는 관찰할 수 없습니다. 또는 (그림 3B처럼) 주요 전이와 함께 콘볼루션된 것으로 나타납니다. 사전 전이와 주요 전이가 콘볼루션된 것으로 나타나면 두 피크를 디콘볼루션할 수 없기 때문에 곡선이 벗어나기 시작하는 온도부터 기준선으로 돌아올 때까지 통합을 수행해야 합니다. 이 경우에는 12°C~35°C 사이에서 모든 LUV 통합을 수행했습니다. 즉, 주요 및 사전 전이를 함께 수행하였습니다.
동일하거나 다른 시료 제제(항상 막 방법을 사용)에서 나오거나 스캔 속도: 60oC/시간, 사전 기간: 15분, 게인: 높음, 필터: 10의 조건을 사용하는 DSC 실험에서 나온 7~10회의 스캔에서 구한 값이 아래에 나와 있습니다.
T pre = (14.7±0.4)°C ∆Hpre = (3.9±0.2) kJ mol-1,
T m = (24.4±0.2)°C, ∆Hm = (26.2±0.6) kJ mol-1
WHH = (0.6±0.1)°C
T m = (24.6±0.1)°C ∆Hm = (26.8±0.3) kJ mol-1
WHH = (1.0±0.1)°C
이 데이터 세트에서 주요 전이(Tm)에 대해 구한 온도에서 MLV와 LUV 간에 큰 차이를 관찰할 수 없었습니다. 엔탈피 변화(∆Hm)에 대한 값과 관련하여 보고된 값은 동일한 상 변화를 정확하게 반영하지 않습니다. MLV의 경우 값은 리플에서 액체 결정상으로의 전이(Pb'에서 La)에 대한 엔탈피 변화를 가리키고, LUV의 경우 보고된 DHm 값은 겔에서 액체 결정상으로의 전이에 대한 엔탈피 변화를 반영합니다(그림 1 참조).
마지막으로, LUV에 대한 값이 MLV에 대해 나온 값의 거의 두 배이기 때문에 WHH의 차이는 예상대로 매우 큽니다.
나온 결과는 유사한 연구에 대한 문헌[20,33]에서 보고된 값과 일치합니다. 하지만 광범위한 값을 찾을 수 있으며, 이로서 적절한 제제 및 통합 프로토콜의 중요성과 실험 조건에 대한 전체 보고서의 필요성이 중요하다는 것을 알 수 있습니다.
MLV와 LUV 양쪽에 대하여 30°C/시간, 60°C/시간 및 90°C/시간의 세 가지 스캔 속도를 테스트하였습니다. 모든 경우에 비슷한 지점 수를 유지하기 위한 필터를 선택하여 다양한 스캔 속도를 결합했습니다.
| 스캔 속도(°C/hr) | 필터 | Tpre(°C) | ∆Hpre(kJ.mol-1) | WHH(°C) | Tm(°C) | ∆Hm(kJ.mol-1) | WHH(°C) | |
|---|---|---|---|---|---|---|---|---|
| MLV | 30 | 20 | 14.0 | 3.9 | 2.1 | 24.2 | 2.6 | 0.33 |
| 60 | 10 | 14.2 | 3.4 | 2.1 | 24.2 | 26.0 | 0.46 | |
| 90 | 8 | 14.2 | 3.5 | 2.1 | 24.1 | 26.1 | 0.40 | |
| LUV | 30 | 20 | - | - | - | 24.3 | 25.9 | 0.88 |
| 60 | 10 | - | - | - | 24.6 | 26.9 | 1.05 | |
| 90 | 8 | - | - | - | 24.6 | 25.8 | 1.08 |
표에서 관찰된 것처럼 MLV와 LUV 양쪽에 대하여 동일한 리포좀 제제에 대하여 관찰된 전체 불확실성(온도에 대한 ±0.3°C 및 엔탈피에 대한 ±0.5kJ.mol-1) 내에서 전이 온도도 전이 엔탈피도 스캔 속도에 따라 크게 변하지 않습니다. 게다가 전이의 WHH도 적당하게만 변하기 때문에 이러한 지질 전이의 높은 협력성을 고려할 때 이해할 수 있으며 이 유형의 실험에 높은 게인을 사용하는 것이 정당화됩니다.
앞서 언급한 것처럼 리포좀을 다룰 때는 높은 게인을 사용하는 것이 바람직하지만 MLV 및 LUV 양쪽에 대해 다양한 게인 설정을 테스트했습니다. 동일한 시료에 대한 결과를 수집하고 다양한 게인 설정에서 연속적으로 스캔하였습니다.
그림 5에는 세 가지 게인 설정을 사용하여 (사전 및 주요 전이 양쪽에 대한 효과를 보기 위해) MLV에 대하여 수행한 스캔에 대한 결과의 그래프, 전체 곡선(A), 그리고 프로파일의 차이가 분명한 전이 주위의 곡선을 확대한 것(B)이 나와 있습니다. 사전 전이에서는 차이가 미미하지만, 주요 전이에서는 게인이 증가함에 따라 곡선이 날카로워지고 비교적 높은 비열 용량(Cp) 값에 도달하고 게인이 감소함에 따라 오른쪽의 끝부분이 증가하는 것이 분명하게 나타납니다.
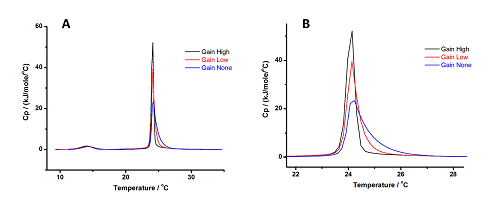
그림 5: 3가지 게인 설정에서 DMPC의 MLV에 대하여 얻은 결과 패널 (A)에는 전체 곡선이 나와 있고, 패널 (B)에는 게인 설정에 따라 생기는 프로파일의 차이를 잘 볼 수 있도록 전이 주위의 곡선을 확대한 것이 나와 있습니다.
측정된 열역학 파라미터의 목록이 표 2에 나와 있습니다.
| 게인 | Tpre(°C) | ∆Hpre(kJ.mol-1) | WHH(°C) | Tm(°C) | ∆Hm(kJ.mol-1) | WHH(°C) |
|---|---|---|---|---|---|---|
| 고 | 14.1 | 3.6 | 2.1 | 24.1 | 26.0 | 0.3 |
| 저 | 14.1 | 3.2 | 2.0 | 24.1 | {26.2} | 0.5 |
| 없습니다 | 14.4 | 2.9 | 2.0 | 24.2 | 26.7 | 0.7 |
게인이 높음에서 없음으로 이동함에 따라 사전 전이의 엔탈피 변화는 감소하는 것으로 보이는 반면에 주요 전이에 대한 엔탈피 변화는 증가합니다. 전체적으로 관찰된 차이가 결합된 불확실성(온도의 경우 ± 0.3°C, 엔탈피 변화의 경우 ± 0.5kJ.mol-1) 내에 있기 때문에 이러한 효과는 미미합니다.
장비의 감지 한계를 알아보기 위해, 즉, 신뢰할 수 있는 결과를 얻는 데 필요한 가능한 최저 농도를 찾기 위해 지질 농도 변화의 효과를 테스트하였습니다.
이를 위해 3mM 농도부터 시작하여 최대 20mM까지 1:1로 연속적으로 MLV 시료를 희석하였고 각 새 용액을 동일한 조건에서 스캔하였습니다. 결과는 표 3에 나와 있습니다.
| 농도(mM) | Tpre°C) | ∆Hpre(kJ.mol-1) | Tm(°C) | ∆Hm(kJ.mol-1) |
|---|---|---|---|---|
| 3.06 | 14.2 | 3.6 | 23.8 | 26.1 |
| 1.53 | 14.3 | 4.8 | 23.8 | 25.7 |
| 0.764 | 13.1 | 4.3 | 23.6 | 25.0 |
| 0.382 | 13.3 | 5.8 | 23.6 | 25.2 |
| 0.191 | 13.7 | 3.2 | 23.8 | 20.8 |
| 0.0955 | - | - | 23.8 | 17.1 |
| 0.0478 | - | - | 23.8 | 23.3 |
| 0.0239 | - | - | 23.8 | 19.1 |
참고: 결과는 동일한 지질 제제에 대한 것이기 때문에 불확실성을 (온도에 대한 ± 0.3°C와 엔탈피 변화에 대한 ± 0.5kJ.mol-1)로 간주할 수 있습니다.
동일한 값에서 최저 20mM까지의 농도에 대하여 주요 전이의 온도를 여전히 감지할 수 있다는 것은 주목할 만한 일입니다. MLV의 경우, 최저 0.2mM까지의 농도와 최저 0.4mM까지의 적당한 엔탈피 변화값에서 양쪽 전이에 대하여 신뢰할 수 있는 온도 결과를 측정할 수 있습니다. 더 낮은 농도에서는 곡선을 정확하게 통합하기 어려워지고 결과적으로 값이 가변적이고 신뢰할 수 없게 됩니다.
예상대로 노화는 회수된 파라미터에 영향을 주는 것으로 관찰되었습니다. MLV 및 LUV에 대하여 얻은 결과는 리포좀 제제 후 최대 2주 동안 측정한 시료에 대해서는 일관적이었지만, 이 시간이 지나면 물질이 저하됩니다. 따라서 산화를 방지하기 위해 어두운 용기에 넣어 냉장고에 보관한 경우라도 2주를 넘은 시료는 사용하지 않는 것이 좋습니다.
지질 혼합물을 이용하는 한편 지질 혼합물(모델 막) 및 항균 펩타이드를 대상으로 상호 보완적 실험을 수행하였습니다. 분자비가 3:1인 DMPC와 DMPG를 혼화성과 거동이 이상에 가까운 지질 혼합물의 예로 제시하며, 역시 분자비가 3:1인 POPE와 POPG를 비이상적인 거동이 두드러진 지질 혼합물의 예로 제시합니다. 이 두 가지 지질 혼합물은 항균 펩타이드 연구에서 병원체 막(특히 균류)을 모방하기 위한 모델 막으로 사용되었습니다[20,26,37-39]. 모든 리포좀은 HEPES 완충액(10mM HEPES,150mM NaCl, pH 7.4)에서 준비되었습니다.
리포좀은 지질 막 방법(지질 혼합물)으로 준비하였고 위에서 설명한 프로토콜에 따라 압출하였습니다. (PG 성분에서 발생하는) 막의 전하로 인해 이러한 지질 혼합물은 올리고층 소포(OLV)를 형성합니다.즉, 압출 전에는 리포좀에 이중층이 한 쌍만 존재합니다.
실험은 60°C/hr, 온도 범위:
10°C~35°C, 사전 기간: 15분, 게인: 높음 및 필터: 10의 조건에서 OLV를 사용하여 수행하였습니다. 결과는 그림 6에서 확인할 수 있습니다.
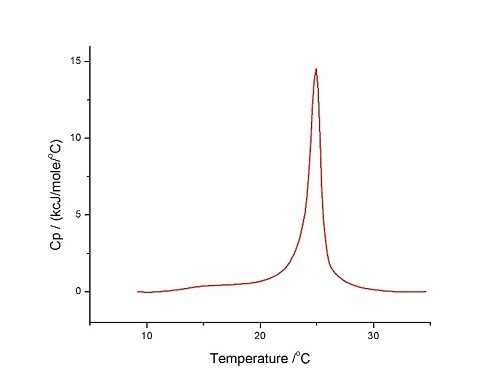
Figure 6 60°C/hr, 온도 범위: 10°C~35°C, 사전 기간: 15분, 게인: 높음, 필터: 10의 조건에서 수행한 HEPES 완충액(10mM HEPES, 150mM NaCl, pH 7.4)에서의 DMPC/DMPG 3:1 몰 혼합물의 LUV에 대한 DSC 분석
곡선은 상당히 대칭적이고 순수 DMPC LUV에 대해 위에서 보고된 것과 유사하여, 이 두 가지 지질에 대해 이상에 가까운 혼합을 나타냅니다. 순수 지질에 대한 열역학 파라미터가 다음과 같다는 것을 알고 있습니다.
DMPC
T m = 24.6°C ∆Hm = 26.8 kJ mol-1(이 연구)
DMPG
T m = 23.7°C ∆Hm = 26 kJ mol-1[38]
(다양한 시료 제제에 대하여) 여기에서 얻은 것처럼 혼합물에서 독립 성분과 비슷한 파라미터가 나타난다는 것이 분명합니다.
T m = 24.9°C±0.5°C ∆Hm = 27±3 kJ mol-1(이 연구)
이 지질 혼합물은 모델 막 연구에서 박테리아 막 모방으로 널리 사용됩니다. 두 지질은 비이상적으로 혼합되며, 특히 xPOPG=0.5[40]를 넘는 비대칭 프로파일을 나타냅니다. 순수 지질에 대한 파라미터는 다음과 같습니다.
T m = 24.7°C 및 ∆Hm = 20.5 kJ mol-1(POPE의 경우),
T m = -5.3°C 및 ∆Hm = 20.5 kJ mol-1(POPG의 경우)[40].
이 분석도 60°C/hr, 온도 범위: 10°C~35°C(OLV) 및 4°C~35°C(LUV), 사전 기간: 15분, 게인: 높음, 필터: 10의 조건에서 수행하였습니다. 결과는 그림 7에 나와 있습니다.
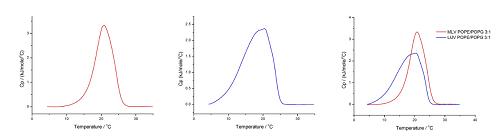
그림 7. 60°C/hr, 온도 범위: 10°C~35°C(OLV (A)) 및 4°C~35°C(LUV (B))(중첩은 (C)에 표시), 사전 기간: 15분, 게인: 높음, 필터: 10의 조건에서 수행한 HEPES 완충액(10mM HEPES, 150mM NaCl, pH 7.4)에서의 POPE/POPG 3:1에 대한 DSC 분석
POPE/POPG 3:1 혼합물에 대한 우리 그룹의 분석에서 Tm은 OLV의 경우에는 20.7°C로 나타나고 LUV의 경우에는 20.4°C로 나타났는데, 이 값은 다른 그룹에서 나타난 값과 일치합니다(OLV의 경우, xPOPG=0.18에 대해서는 22.7°C이고 xPOPG=0.30에 대해서는 20.6°C로 나타났으며[40], LUV에 대해서는 20.4°C로 나타났습니다[41]). 전이 엔탈피의 경우, ΔtransH가 OLV에 대해서는 22kJmol-1이고 LUV에 대해서는 24kJmol‑1로 나타났으며, 이는 문헌의 값과 일치합니다(xPOPG=0.18에 대해서는 24.2kJmol-1이고 xPOPG=0.30에 대해서는 25.5kJmol-1이며[40], LUV에 대해서는 22kJmol-1[41]).
모델 막은 요인 분석을 수행하기 위해 체계적인 방법으로 특성을 쉽게 변경할 수 있는 단순한 시스템을 제공하기 때문에 생물물리학 연구에서 널리 사용됩니다. 예를 들어, 전하, pH, 지질 사슬 길이, 포화, 지질 헤드 그룹, 완충액, 이온 강도 등을 변경할 수 있습니다.
DSC는 조성이 다양한 막을 사용하여 약물, 펩타이드 및 단백질에 대한 상호 작용에 대한 우수한 첫 번째 스크리닝 도구를 제공합니다. 항균 펩타이드(AMP)의 사례를 예로 들면, 진핵 세포 및 병원체 막을 모방하는 막에 대한 상호 작용을 DSC[20,21,26,42,43]로 쉽게 테스트할 수 있고 미생물학 연구[38,39]에 대한 상관 관계도 우수한 것으로 나타났습니다.
CA(1-7)M(2-9)은 세크로핀 A에서 나온 아미노산 1-7을 포함하고 멜리틴에서 나온 2-9를 포함하는 하이브리드 펩타이드[44]로 매우 다양한 병원성 제제에 대하여 활성화되는 것으로 알려져 있습니다[44-46]. 이 물질과 다양한 조성의 막에 대한 상호 작용을 DSC에서 연구하여 항균 작용 및 용혈능과 상관 관계가 있는 매우 흥미로운 결론을 제공하였습니다. 상호 작용 파라미터를 테스트하려면 진핵 세포막 또는 병원성 세포막을 모방하도록 막전하를 변경해야 합니다.
시료간 변화로 동일한 리포좀 현탁액의 다양한 제제에 대한 DSC 분석으로 측정한 열역학 파라미터에 영향이 생길 수 있습니다. 따라서 이러한 연구를 수행할 때 테스트할 모든 펩타이드/지질 혼합물에 동일한 배치 제제를 사용해야 합니다.
순수 지질은 동일한 조건에서 실행되며 펩타이드의 존재로 인한 지질 거동의 변화를 평가할 때 혼합물의 거동을 비교하기 위한 기준선 역할을 합니다. AMP/막 연구의 경우 항생물질 사용을 모방하기 위해 펩타이드를 사전 제제 MLV 또는 LUV 현탁액에 추가해야 합니다. AMP의 효과를 분석하는 동안에 Tm의 변화(겔상의 안정화/불안정화. 즉, 액체 결정상에서의 상호 작용 개선/악화) 및 ∆Hm(리포좀 파괴, 분리가 존재하는 경우 피크 성분의 상대적 중요성)과 함께 프로파일 변화(막 파괴 또는 유도 분리를 나타낼 수 있음)를 관찰해야 합니다.
이 유형의 연구를 설명하기 위해 다양한 분자비(P:L)에서 CA(1-7)M(2-9)와 POPE/POPG 3:1 LUV의 혼합물에 대한 DSC 프로파일 및 온도의 변화를 아래에서 보여줍니다(그림 8). 펩타이드 함량이 낮으면 주요 전이가 더 날카롭고(보다 협력적) 약간 높은 온도에서 나타나지만 펩타이드 함량이 계속 증가함에 따라 막 분리(1:40)와 심각한 파괴(1:15)가 관찰됩니다. 자세한 내용은 [41]에서 확인할 수 있습니다.
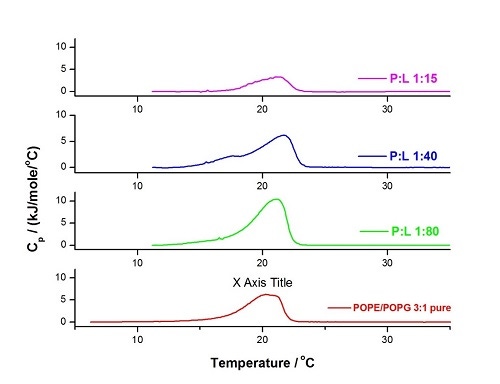
그림 8. 60°C/hr, 온도 범위: 5°C~35°C, 사전 기간: 15분, 게인: 높음 및 필터: 10의 조건에서 수행한 HEPES 완충액(10mM HEPES, 150mM NaCl, pH 7.4)에서의 POPE/POPG 3:1의 LUV에 대한 DSC 실험. 순수 지질 혼합물(빨간색)과 펩타이드 대 지질 분자비가 서로 다른 3개 혼합물에 대하여 분석을 수행하였습니다
.
DSC는 막 거동 특성화에 대한 기본 기법으로 온도 유도 전이에 대한 모든 열역학 파라미터를 제공합니다. 또한 다른 성분(약물, 단백질, 펩타이드, 고분자 등)과 막의 혼합물의 경우 DSC는 막 거동에 대한 추가된 성분의 효과에 관한 정보를 제공하는 일선 스크리닝 방법을 나타냅니다.
나온 파라미터의 품질 및 재현성은 시료 제제, 정확한 농도 결정, 실험 설정, 청소 절차 등과 같은 제제 및 취급 프로토콜에 크게 좌우됩니다. 또한, 서로 다른 연구실에서 얻은 데이터를 비교하기 위해서는 기본적으로 후속 보고서의 모든 세부 사항을 명확하게 설명해야 합니다.
Fundação para a Ciência e Tecnologia (FCT) 및 European Social Funds for CIQ-UP의 전략적 프로젝트인 Pest-C/QUI/UI0081/2011 및 Pest-C/QUI/UI0081/2013에게 감사를 드립니다. MB는 수년에 걸쳐 DSC 막에 대한 연구를 완료한 제자들에게 감사를 드리고 싶습니다(Filipa Abrunhosa, Regina Adão, Guangyue Bai, Vitor Teixeira, Tânia Silva, Inês Martins, Susana Correia). A.C.P. Águas는 F.C.T.입니다. Doctoral Fellow(SFRH/BD/88958/2012).
1. Chapman, D., Biological Membranes. 1968, London: Academic Press.
2. Goñi, F.M., 세포막의 기본 구조 및 역학: Singer–Nicolson 모델의 업데이트.BBA - 생체막, 2014. 1838(6):1467-1476.
3. Lindner, R. and H.Y. Naim, 생물학적 막의 영역.Exp. Cell Res. 2009. 315(17):2871-2878.
4. Nicolson, G.L., The Fluid-Mosaic Model of Membrane Structure: 40년이 지난 현재에도 생물학적 막의 구조, 기능 및 역학 관계를 이해하는 데 중요합니다. Biochim. Biophys. Acta, 2014. 1838(6):1451-1466.
5. Goñi, F.M., A. Alonso, L.A. Bagatolli, R.E. Brown, D. Marsh, M. Prieto, and J.L. Thewalt, 막 뗏목의 연구와 관련된 지질 혼합물의 상 다이어그램. (BBA) – Mol. Cell Biol. Lip, 2008. 1781(11–12):665-684.
6. Marsh, D., 콜레스테롤 유도 유체 막 영역: 지질-뗏목 삼상 다이어그램의 개요. Biochim. Biophys. Acta, 2009. 1788(10):2114-23.
7. Vaz, W.L.C. and T.P. Begley, Lipid Bilayers: Properties, in Wiley Encyclopedia of Chemical Biology. 2007, John Wiley & Sons, Inc.
8. Mouritsen, O.G., Life - As a Matter of Fat: The Emerging Science of Lipidomics. 2005: Springer.
9. Liposome Technology: Interactions of Liposomes with the Biological Milieu. 3rd ed. Vol. III. 2006, New York: CRC Press.
10.Liposomes, Lipid Bilayers and Model Membranes. From Basic Research to Application. . 2014, Boca Raton: CRC Press, Taylor & Francis group.
11. Allen, T.M. and P.R. Cullis, Liposomal drug delivery systems: From concept to clinical applications. Adv. Drug Deliv. Rev., 2013. 65(1):36-48.
12. Arouri, A., M. Dathe, and A. Blume, Peptide induced demixing in PG/PE lipid mixtures: A mechanism for the specificity of antimicrobial peptides towards bacterial membranes? BBA - 생체막, 2009. 1788:650–659.
13. Blume, A. and P. Garidel, Lipid Model Membranes and Biomembranes, in Handbook of Thermal Analysis and Calorimetry, pages 109-173. R.B. Kemp, Editor. 1999, Elsevier Press: Amsterdam.
14. El Maghraby, G.M., B.W. Barry, and A.C. Williams, Liposomes and skin: From drug delivery to model membranes. Eur. J. Pharm. Sci., 2008. 34(4–5):203-222.
15. Hancock , R.E.W. and A. Rozek, Role of membranes in the activities of antimicrobial cationic peptides.FEMS - Microbiology Letters, 2002. 206:143-149.
16. Matos, C., J.L.C. Lima, S. Reis, A. Lopes, and M. Bastos, Interaction of antiinflammatory drugs with EPC liposomes: Calorimetric study in a broad concentration range.Biophys. J., 2004. 86(2):946-954.
17. Pattni, B.S., V.V. Chupin, and V.P. Torchilin, New Developments in Liposomal Drug Delivery. Chem. Rev., 2015. 115(19):10938-10966.
18. Sandström, M.C., L.M. Ickenstein, L.D. Mayer, and K. Edwards, Effects of lipid segregation and lysolipid dissociation on drug release from thermosensitive liposomes.J. Control. Release, 2005. 107(1):131-142.
19. Van Vlierberghe, S., P. Dubruel, and E. Schacht, Biopolymer-Based Hydrogels As Scaffolds for Tissue Engineering Applications: A Review.Biomacromolecules, 2011. 12(5):1387-1408.
20. Abrunhosa, F., S. Faria, P. Gomes, I. Tomaz, J.C. Pessoa, D. Andreu, and M. Bastos, 두 세크로핀-멜리틴 하이브리드 펩타이드의 상호 작용 및 지질 유도 형태는 펩타이드 및 막 조성에 따라 달라집니다. J. Phys. Chem. B 2005. 109(36):17311-9.
21. Arouri, A., M. Dathe, and A. Blume, KLA 양친매성 펩타이드의 나선 성향이 있으면 겔 상태 지질 막에 대한 결합이 강화됩니다. Biophys. Chem., 2013. 180-181:10-21.
22. Bai, G., M. Nichifor, and M. Bastos, Association and Phase Behavior of Cholic Acid-Modified Dextran and Phosphatidylcholine Liposomes.J. Phys. Chem. Lett. 2010. 1(6):932-936.
23. Benesch, M.G.K. and R.N. McElhaney, 디팔미토일포스파티딜콜린 이중층 막의 열방성 상 거동에 대한 콜레스테롤과 식물성 스테롤 캄페스테롤 및 브라시카스테롤의 효과에 관한 비교 열량 측정 연구.BBA - Biomembranes, 2014. 1838(7):1941-1949.
24. Blume, A., 생물학적 막의 물리적 특성과 기능적 영향에서 지질 모델 막에 대한 열량측정법의 응용., 41-121페이지. C. Hidalgo, 편집자. 1988, Plenum Press: New York.
25. Ivanova, V.P., I.M. Makarov, T.E. Schäffer, and T. Heimburg, 펩타이드 함유 막의 열 용량 프로파일 분석: 그라미시딘 A의 군집 형성. Biophys. J., 2003. 84:2427-2439.
26. Teixeira, V., M.J. Feio, and M. Bastos, 막과 항균 펩타이드 상호 작용에서의 지질의 역할. Prog. Lipid Res., 2012. 51(2):149-177.
27. Chiu, M. and E. Prenner, 시차 주사 열량측정법: 거대분자 및 거대분자의 상호 작용에 대한 상세한 열역학 특성화에 매우 귀중한 도구.J. Pharm. Bioallied Sci., 2011. 3(1):39-59.
28. Garidel, P. and A. Blume, 헤드 그룹이 동일하고 아실 사슬 길이가 두 메틸렌 단위 만큼 차이가 나는 인지질의 혼화성: 헤드 그룹 구조 및 헤드 그룹 전하의 효과. BBA - 생체막, 1998. 1371(1):83-95.
29. Garibel, P. and A. Blume, pH 및 아실 사슬 길이의 함수로 표현한 포스파티딜에탄올아민-포스파티딜글리세롤 혼합물의 혼화성.Eur. Biophys. J., 2000. 28(8):629-638.
30. Garidel, P., C. Johann, and A. Blume, 정규 용액 이론을 기반으로 한 열 용량 곡선 및 상 다이어그램의 계산.J. Therm. Anal. Cal., 2005. 82(2):447-455.
31. Garidel, P., C. Johann, and A. Blume, 포스파티드산-포스파티딜에탄올아민 혼합 이중층에서의 비이상적인 혼합 및 유체-유체 불혼화성.Eur. Biophys. J., 2011. 40(7):891-905.
32. Caffrey, M., LIPIDAT A Database of Thermo Data and Association Information on Lipid. 1993, Boca Raton Anne Arbor London Tokyo: CRC Press.
33. Koynova, R. and M. Caffrey, 포스파티딜콜린의 상 및 상 전이. Biochim. Biophys. Acta, 1998. 1376(1) 91-145.
34. Marsh, D.,인지질 및 당지질 막에 대한 사슬-용융 전이 온도의 구조적 및 열역학 결정 인자.BBA - 생체막, 2010. 1798(1):40-51.
35. Marsh, D., Handbook of lipid bilayers. 2nd edition. 2013, Boca Raton: CRC Press - Taylor & Francis Group.
36. McClare, C.W., 정확하고 편리한 유기 인 분석.Anal. Biochem., 1971. 39(2):527-30.
37. Bastos, M., T. Silva, V. Teixeira, K. Nazmi, Jan G.M. Bolscher, Sérgio S. Funari, and D. Uhríková, Lactoferrin-Derived Antimicrobial Peptide Induces a Micellar Cubic Phase in a Model Membrane System. Biophys. J., 2011. 101(3):L20-L22.
38. Bolscher, J.G.M., R. Adão, K. Nazmi, P.A.M. van den Keybus, W. van ’t Hof, A.V. Nieuw Amerongen, M. Bastos, and E.C.I. Veerman, LFchimera의 살균 활동은 자신의 성분인 락토페리신 및 락토페람핀 펩타이드보다 강하고 이온 강도에 대한 감도는 낮습니다. Biochimie, 2009. 91(1):123-132.
39. Silva, T., R. Adão, K. Nazmi, J.G.M. Bolscher, S.S. Funari, D. Uhríková, and M. Bastos, 세 락토페린 살칸디다 펩타이드의 지질 막에 대한 작용 양식 및 구조적 다양성.BBA - 생체막, 2013. 1828(5):1329-1339.
40. Pozo Navas, B., K. Lohner, G. Deutsch, E. Sevcsik, K.A. Riske, R. Dimova, P. Garidel, and G. Pabst, 박테리아 모델 막 시스템에서 소포 형태 및 혼합 특성의 조성 의존성.BBA - 생체막, 2005. 1716(1):40-48.
41. Teixeira, V., M.J. Feio, L. Rivas, B.G. De la Torre, D. Andreu, A. Coutinho, and M. Bastos, Influence of Lysine Nε-Trimethylation and Lipid Composition on the Membrane Activity of the Cecropin A-Melittin Hybrid Peptide CA(1−7)M(2−9). J Phys Chem B, 2010. 114(49):16198-16208.
42. Epand, R.F., P.B. Savage, and R.M. Epand, 박테리아 지질 조성 및 양이온 스테로이드 화합물(세라게닌)의 항균 효능. BBA - 생체막, 2007. 1768:2500–2509.
43. Epand, R.M. and R.F. Epand, 박테리아 막의 영역 및 항균제의 작용. Mol. Biosyst., 2009. 5:580-587.
44. Andreu, D., J. Ubach, A. Boman, B. Wåhlin, D. Wade, R.B. Merrifield, and H.G. Boman, 세크로핀 A-멜리틴 하이브리드 단축. 크기가 크게 감소해도 항생물질 활동의 효능은 유지됩니다.FEBS Lett., 1992. 296(2):190-194.
45. Chicharro, C., C. Granata, R. Lozano, D. Andreu, and L. Rivas, N-Terminal Fatty Acid Substitution Increases the Leishmanicidal Activity of CA(1-7)M(2-9), a Cecropin-Melittin Hybrid Peptide. Antimicrob. Agents Chemother, 2001. 45(9):2441-2449.
46. Rodríguez-Hernández, M.J., J. Saugar, F. Docobo-Pérez, B.G. de la Torre, M.E. Pachón-Ibáñez, A. García-Curiel, F. Fernández-Cuenca, D. Andreu, L. Rivas, and J. Pachón, 아시네토박테르 바우마니의 콜리스틴 내성 임상 분리주에서 세크로핀 A-멜리틴 하이브리드 펩타이드의 항균 활동에 대한 연구.J. Antimicrob. Chemother, 2006. 58(1):95-100.