나노 입자 추적 분석(NTA)은 엑소좀의 안정성을 평가하고 응집체 형성이 적은 최적 보관 조건을 결정하는 데 사용됩니다. 이 실험에서는 샘플을 4°C와 실온 등 서로 다른 두 온도에서 보관한 다음 엑소좀의 크기와 농도를 LM10으로 측정하였습니다.
세포외 소포체(extracellular vesicles)는 최근 집중적인 연구가 이루어지고 있는 분야입니다. 이 소포체(vesicles)는 광범위한 진핵생물과 원핵생물에 존재하며 다양한 생리적, 병리학적 과정과 관련이 있는 것으로 보입니다. 소포체는 일반적으로 세포의 엔도좀에서 생성되는 엑소좀과 세포막 발아에 의해 생성되는 미세소포로 나뉩니다. 이 세포형 물질의 발생, 구조, 기능 및 특성에 대해서는 여전히 많은 논란이 있습니다. 또한 크기에 대해서도 같은 논란이 있지만 대체로 연구자들 사이에서는 크기가 더 작은(직경 100nm 미만) 것을 엑소좀 소포체로, 더 큰(일반적으로 최대 직경 1µm까지) 것을 미세소포로 분류하는 것으로 합의되어 있습니다.
세포외 소포체의 역할 및 다른 소포체와의 임상적 관련성에 대해서는 지속적인 연구가 이루어지고 있으나, 무엇보다 시험 중인 모든 샘플에 대해 안정성을 이해하여 미세한 차이점이라도 시험 조건에 제대로 반영되도록 하고 샘플 자체의 내재적 불안정성을 증폭시키는 일이 없도록 하는 것이 중요합니다.
여기서는 나노 입자 추적 분석(NTA)을 이용하여 4°C와 실온에서 최대 5일간 보관한 엑소좀의 크기와 농도를 측정한 실험에 대해 설명합니다.
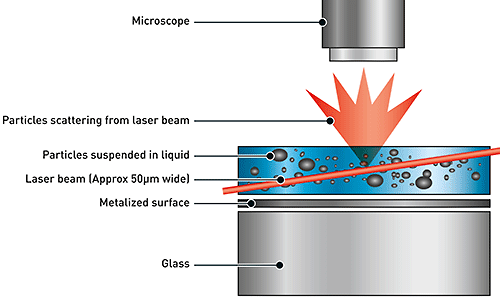
NTA에는 현탁액(liquid suspension) 내 샘플의 입자 크기 분포를 확인하기 위해 광 산란과 브라운 운동의 속성을 모두 활용합니다. 샘플 챔버에 레이저를 통과시키면 현탁액에서 이 광선의 경로에 있는 입자가 빛을 산란시켜 카메라가 장착된 20배율 현미경으로 쉽게 시각화할 수 있습니다. 초당 약 30프레임(fps)으로 작동하는 카메라가 약 100μm x 80μm x 10μm의 시야 내에서 브라운 운동을 하는 입자의 이미지 비디오 파일을 캡처합니다(그림 A).
|
입자의 움직임이 프레임별로 캡처됩니다. 특허 받은 NTA 소프트웨어가 관찰된 입자 각각의 중심부를 동시에 식별하고 추적하며 XY 평면에서 각 입자의 평균 이동 거리를 측정합니다. 이 값을 이용하여 입자 확산 계수(Dt)를 측정하고 샘플 온도(T)와 용매 점도(η)를 알고 있다는 가정 하에 이 값을 스톡스-아인슈타인 방정식(방정식 1)에 대입하여 구형으로 가정한 입자의 유체역학적 직경(d)을 계산할 수 있습니다.
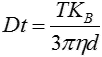
|
여기서 KB는 볼츠만 상수입니다.
NTA는 많은 숫자의 입자를 종합적으로 다루는 총체적 측정 기법이 아니라 입자 하나 하나의 크기를 다른 입자의 크기에 상관없이 개별적으로 측정하는 기법입니다. NTA를 통해 작성된 입자 크기 분포 프로파일이 그림 B에 예로 제시되어 있습니다.

|
또한 정해진 관찰 영역(대략 100μm x 80μm) 내에서 약 10μm 깊이에서 레이저를 조사하는 조건 하에 입자 운동이 측정되었습니다. 이 그림을 통해 샘플의 산란 체적을 추정해 볼 수 있습니다. 관찰 영역 내에서 입자 농도를 측정하고 더 큰 체적을 추론함으로써 주어진 모든 크기 수준에 대해서나 전체 체적에 대해 mL당 입자 수 단위의 농도 추정치를 구할 수 있습니다.
sCMOS 카메라와 405nm 레이저로 구성된 두 대의 NanoSight LM10 HSB 시스템이 사용되었습니다. 데이터 분석에는 NTA 소프트웨어 2.3.5를 사용했습니다.
사람 소변과 혈장에서 채취한 엑소좀을 동결 건조시키고 일정 시간 동안 4°C에 보관하였습니다.
인산염 완충액(PBS, Life technologies 제조)을 적정 시간 동안 4°C 조건에 보관하고 사용 전에 입자가 섞여 있지 않은 것을 확인했습니다.
소변 유래 엑소좀을 100µL PBS에 다시 용해시키고 피펫을 사용해 10회 혼합하였습니다. 900µL PBS를 더 추가하고 피펫으로 샘플과 섞었습니다. 그런 다음 엑소좀을 19mL PBS가 들어 있는 다른 시험관으로 옮겨 부드럽게 좌우로 흔들며 섞었습니다. 마지막으로 이 샘플 10mL를 깨끗한 시험관에 옮겨 담고 4°C(exo4_U) 조건에서 일정 기간 동안 보관하였습니다. 나머지 샘플은 실온(20-22°C)(exoRT_U)에 보관하였습니다.
혈장에서 채취한 엑소좀도 이와 유사한 방법으로 준비하였습니다(exo4_P 및 exoRT_P).
준비 직후 exoRT_U 샘플 약 700µL를 1mL 실리콘 오일프리 주사기를 사용해 레이저 샘플 챔버에 로딩하였습니다. 샘플 챔버를 장비에 로딩하였습니다. 카메라 레벨을 16으로 설정하고 이미지를 조정하여 입자에 초점이 맞춰지도록 했습니다. 카메라 히스토그램과 표 1에 제시된 임계값 설정을 이용해 이미지의 색 대비를 한 단계 더 높였습니다. 60초 분량의 비디오 3회 측정하고 측정 회차 간에 샘플 부피는 100µL씩 추가하였습니다. 샘플을 교체할 때마다 약 5mL PBS로 샘플 챔버를 헹궈냈습니다. 위에 설명된 것과 같이 샘플을 각각 0, 60, 120, 180, 300분, 그리고 24시간과 5일간 배양한 후 측정하였습니다.
exo4_U 샘플에 대해서는 카메라 레벨을 16으로 설정하고 위의 배양 시간이 경과하는 시점에 이전과 동일한 방식으로 측정하였습니다.
준비 직후 exoRT_P 샘플 약 700µL를 1mL 실리콘 오일프리 주사기를 사용해 레이저 샘플 챔버에 로딩하였습니다. 샘플 챔버를 장비에 로딩하였습니다. 카메라 레벨을 13으로 설정하고 이미지를 조정하여 입자에 초점이 맞춰지도록 했습니다. 카메라 히스토그램과 표 1에 제시된 임계값 설정을 이용해 이미지의 색 대비를 한 단계 더 높였습니다. 60초 분량의 비디오 3회 측정하였습니다. 위에 언급된 것과 동일하게 0, 60, 120, 180, 300분, 그리고 24시간과 5일이 경과하는 시점에 각각 측정을 실시하였습니다. Exo4_P 샘플도 카메라 레벨을 13으로 설정하고 같은 방식으로 측정하였습니다.
모든 샘플 비디오는 측정이 모두 완료된 후 오프라인으로 분석하였습니다. 소변에서 채취한 엑소좀에 대해서는 모든 비디오를 검출 임계값 4 또는 5를 적용하여 분석하였습니다. 혈장에서 채취한 엑소좀의 경우에는 배양 시간이 60분 이하인 샘플에 대해 검출 임계값을 4로 하고 배양 시간이 120분에서 24시간 사이인 샘플은 임계값 6을, 5일간 배양한 샘플은 임계값 3을 적용하였습니다. 모든 샘플에 대해 크기 분포 프로파일과 농도 데이터를 수집하였습니다.
| 시간(분) | 소변 유래 엑소좀 | 혈장 유래 엑소좀 | ||||||
|---|---|---|---|---|---|---|---|---|
| RT | 4°C | RT | 4°C | |||||
| 저 | 고 | 저 | 고 | 저 | 고 | 저 | 고 | |
| 0 | 195 | 2535 | 390 | 4420 | ||||
| 60 | 195 | 5470 | 195 | 3120 | 390 | 4420 | 390 | 4420 |
| 120 | 195 | 2535 | 195 | 2080 | 390 | 4420 | 390 | 4420 |
| 180 | 260 | 2340 | 260 | 2340 | 390 | 4420 | 390 | 4420 |
| 300 | 195 | 2535 | 195 | 2535 | 390 | 4420 | 390 | 4420 |
| 1440 | 195 | 2535 | 195 | 3250 | 390 | 4420 | 390 | 4420 |
| 7220 | 195 | 3510 | 195 | 2535 | 0 | 6588 | 0 | 6588 |
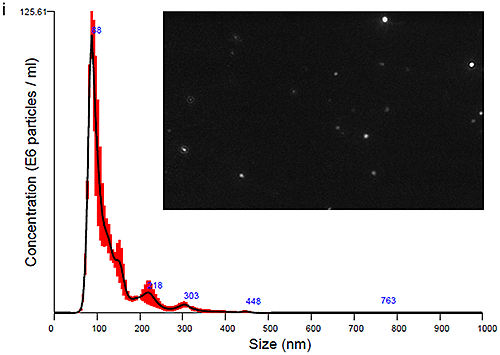
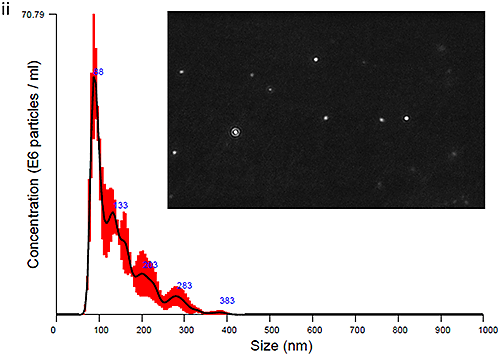
혈장 유래 엑소좀과 소변 유래 엑소좀을 모두 NanoSight LM10 장비로 측정하여 크기 분포 프로파일을 도출했습니다. 시작 시점(0시간 경과)에 얻은 데이터는 그림 Ci(혈장 엑소좀)과 그림 Cii(소변 엑소좀)에 입자 이미지와 함께 제시되어 있습니다. 최적의 이미지(그림 Ci 및 Cii)를 얻기 위해 카메라 히스토그램 설정(표1)을 조절하여 입자와 배경의 색 대비를 높여야 했으며 혈장 유래 엑소좀에 대해 더 높은 색 대비가 필요했습니다.
|
|
PBS-엑소좀 현탁액은 기본적으로 생체에서 유래하였으며 여기서 설명하는 방식으로 처리된 샘플이 일반적으로 그렇듯 약간의 단분산성을 나타냈습니다. 모달 피크가 90nm 주변에 나타났고 이보다 더 작은 피크들이 각각 140nm, 200nm, 300nm 근처에 나타났습니다.
소변과 혈장에서 채취한 엑소좀 모두에 대해 4°C 및 실온 보관 현탁액의 농도와 모달 입자 크기가 그림 D에 제시되어 있습니다. 5일 배양 샘플의 경우 소변 유래 엑소좀은 두 가지 배양 온도 조건에서 모두 입자 크기가 거의 달라지지 않았습니다. 이와 달리 혈장 유래 엑소좀은 입자 크기가 5일(7200시간) 경과 시점에 약간 줄어든 것으로 나타났습니다. 농도는 두 유형의 엑소좀 모두 배양 시간이 길어짐에 따라 감소하는 것으로 나타났습니다. 이러한 감소 추세는 혈장 유래 엑소좀에서 더 따르게 진행되어 배양 시작 후 2시간만에 최초 농도의 60% 수준으로 떨어졌습니다. 5일 후에는 시작 농도의 30% 수준으로 측정되었습니다. 소변 유래 엑소좀의 농도는 처음 3시간까지는 상당히 안정된 모습을 보이다가 24시간 경과 시점에는 시작 농도의 50% 수준으로 떨어졌습니다. 두 샘플 모두 크기 분포 프로파일에서 큰 입자의 수가 증가하지 않았으며, 따라서 이와 같은 농도 감소는 엑소좀이 측정 장비로 검출이 불가능한 정도의 작은(25nm 이하) 분절체로 분해되는 것에 기인할 가능성이 매우 높습니다.
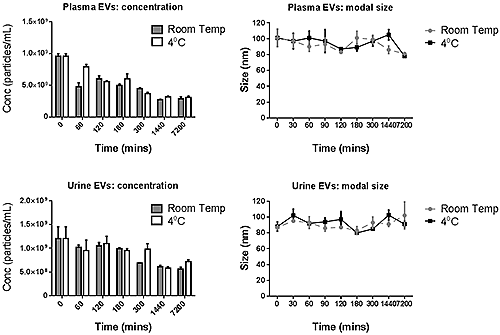
|
NanoSight NTA 측정을 통해서는 엑소좀의 크기와 농도를 신속하게 측정하여 실온과 4°C에서 보관한 PBS 현탁액에서의 입자 안정성을 평가할 수 있습니다. 이 두 온도 조건은 연구 과정에서 유사 성격의 샘플을 다양한 방식으로 분석할 때 흔하게 이용하는 보관 온도입니다. 소변에서 채취한 엑소좀 샘플이 두 가지 온도 조건으로 2시간 배양 후 농도가 50% 감소한 혈장 유래 엑소좀에 비해 크기와 농도 측면에서 더 안정적인 것으로 나타났습니다. 엑소좀을 사용하는 많은 연구에서 이와 유사한 단계의 배양 시간을 적용하기 때문에 혈장 엑소좀의 이러한 불안정성은 연구자들에게는 잠재적으로 중요한 의미를 가질 수 있습니다. 또한 이 결과는 4°C 조건에 샘플을 보관하는 것이 실온에 보관하는 것보다 더 유리하지 않을 수도 있음을 시사합니다. 전체적으로 이 분석 데이터를 통해 이 두 가지 유형의 엑소좀에 대한 처리는 최대한 신속하게 이루어져야 하며 길지 않은 보관 기간도 측정 농도의 정확성에 부정적인 영향을 줄 수 있다는 것을 알 수 있습니다.