이 응용 노트에서는 ITC와 DSC를 사용하여 복합 단백질 용액 제제에서 여러 상호 작용 중의 하나로 단백질-부형제 결합을 분석했습니다.
Biopharmaceutical Technologies, GlaxoSmithKline R&D, 709 Swedeland Rd,
King of Prussia, PA 19406 (USA)
물리적 불안정성(풀림, 응집, 흡착)과 화학적 분해(산화, 탈아미드화, 난할) 등 단백질 고유의 불안정성으로 인해 단백질 기반 치료법을 개발하는 것은 어려운 과제입니다. 이러한 불안정성으로 인해 단백질의 활성이 감소하고 잠재적으로 면역원성 종이 생성될 수 있습니다. 단백질 안정화에 대한 하나의 접근법은 단백질과 접촉하는 용매의 특성을 변화시키는 것인데, 이는 완충계, pH 조절량 및 부형제/첨가제 추가량(최적의 제형 생성)을 유의해서 선택함으로써 이루어질 수 있습니다.
단백질 약품의 용매 기반 안정화에 대한 중요한 사항은 적절한 부형제를 선택하는 것입니다. 또한 부형제 농도를 최적화하여 보관 수명을 연장하고 환자에게 최고의 안전성을 제공하는 것도 중요합니다. 따라서 단백질 약품 제형 개발에서 핵심적인 사항은 적절하게 용해되고 독성이 없으며, 단백질의 구조 무결성을 유지하고 제품 보관 수명이 수용 가능하며 단백질의 생물학적 활성을 보존하는 부형제를 선택하는 것입니다. 부형제에는 아미노산, 염류, 금속, 계면 활성제, 설탕 및 폴리올 및 중합체가 포함될 수 있습니다. 이는 안정제, 계면 활성제, 항미생물제, 또는 산화 방지제 역할을 할 수 있습니다. 부형제의 안정화 효과는 단백질과 농도에 따라 달라집니다.
부형제를 선택하면서 최적의 부형제 농도뿐만 아니라 다양한 제형 성분 간의 상호 작용에 대한 정보를 수집해야 합니다. 각 부형제의 선택과 농도를 최적화하는 것은 광범위한 제형 검사 및 안정성 연구와 관련된 노력이 많이 드는 작업일 수 있습니다. 지난 10년 동안 안정화에 대한 일반적인 원리가 문헌을 통해 소개되었지만(1) 부형제가 보관 중인 단백질의 안정성을 향상시키는 메커니즘은 여전히 완벽하게 파악하지 못하고 있습니다. 단백질과 부형제의 상호 작용에 대한 메커니즘을 파악하게 되면 경험적인 검사 접근법을 수행할 필요가 없고 단백질 제형의 합리적인 설계와 최적화가 가능해지며 단백질 제품 개발에 필요한 시간과 재료가 절감됩니다. 또한 단백질-부형제 상호 작용에 대한 강점과 유형에 대한 정보는 생체 내 단백질 약품 거동을 예측할 수 있도록 해 줍니다.
생물물리학적 분석 기법은 제형 개발에 대한 부형제 검사에서 아주 유용한 것으로 판명되었습니다. 특히, 모든 반응이 가역적인 경우 해당 시스템의 전체 열역학적 분석이 가능하므로 열량측정법은 단백질 안정성과 상호 작용을 평가하기 위한 가장 효율적인 방법 중의 하나입니다. 단백질-부형제 상호 작용을 살펴보기 위한 열량측정 조사방법은 바이오 의약 제형의 설계와 최적화에 적용되고 있습니다. 열량측정법은 연관, 해리, 및/또는 풀림 공정으로 인한 열 변화를 측정하여 거대 분자 상호 작용에 대한 에너지량과 화학량을 측정하는 원리에 기반을 두고 있습니다. ITC는 등온 조건 하의 결합에 대한 화학량, 엔탈피, 엔트로피 및 기브스 자유 에너지뿐만 아니라 결합 친화도 및 해리 상수와 같은 열역학적 결합 매개 변수를 측정하는 데 주로 사용됩니다. 또한 다양한 온도에서 실험을 수행하여 결합에 대한 열 용량 변화를 측정하는 데도 사용됩니다. DSC 데이터는 중간점 풀림 온도, 엔탈피, 엔트로피, 기브스 자유 에너지 및 풀림에 대한 열용량 등 단백질 풀림에 대한 열역학적 매개 변수를 제공합니다.
이 열역학적 매개 변수는 일반적으로 다른 제형에서 단백질 안정성을 비교하거나 특정 부형제에 대한 상대적인 안정화 또는 불안정화 효과를 측정하는 데 사용됩니다.
이 응용 노트에서는 열량측정법이 부형제-단백질 상호 작용에 대한 이해를 도와 ProX의 제형 개발을 어떻게 지원하는지에 대한 예를 제시합니다. ProX의 제형 완충액에 대한 잠재적 첨가제로 폴리소르베이트-80과 페놀을 검사했습니다. 폴리소르베이트-80은 일반적으로 단백질의 불특정 흡착 및 응집을 방지하기 위해 계면 활성제로 사용되고 있고 단백질과 상호 작용하는 데에 효과가 있습니다(2, 3). 또한 단백질 분자 표면에서 노출된 소수성 영역에 결합하여 표면 유도 응집으로부터 단백질을 보호합니다(3). 가장 일반적으로 사용되는 폴리소르베이트-80 수준은 0.002 ~ 0.1%(w/v)입니다. 페놀은 동일한 용기에서 한 번 이상 복용해야 할 제형에 대한 항미생물제로 사용됩니다. 페놀은 독성이 있으므로 제형 완충액에 사용하는 농도를 최소화해야 합니다. 가장 일반적으로 사용되는 수준은 0.3 ~ 0.5%(v/v)입니다.
MicroCalTM VP-Capillary DSC로 실험을 실시했습니다. 400µL의 시료에 상응하는 완충액을 96-웰 플레이트에 배치했습니다. 각 스캔 전 15분간 평형을 유지하고 시간 당 60°C의 주사 속도로 25° ~ 100°C까지 스캔했습니다. 단백질 스캔에 대한 농도 수정과 완충액 제거 후 데이터를 DSC에 대한 Origin 버전 7 소프트웨어로 분석했습니다.
실험은 MicroCal iTC200으로 실시했습니다. 시료 셀은 250µL의 10 또는 25mg/mL의 ProX로 채우고 적정제 시린지는 ProX와 동일한 완충액에서 40µL의 60mM 페놀 또는 50mM 폴리소르베이트-80으로 채웠습니다. 기준 셀은 탈이온수로 채웠습니다. 각 실험에 대해 초당 0.5µL의 속도에서 0.2 ~ 2µL의 부분 시료로 40µL의 적정제를 시료 셀에 주입했습니다. 교반 속도 1000rpm, 기준 전원 초당 5 ~ 8μCal, 하이(high)로 설정된 피드백 모드/게인, 온도 25°C, 초기 지연 시간 60초 등의 설정을 사용했습니다. 완충액-완충액, 적정제 희석 및 ProX 희석에 대한 대조 실행은 각 실험에서 제거했습니다. ITC에 대한 Origin 버전 7로 데이터를 분석했습니다. ITC 실행을 위해 시료를 사용하기 전 0.2μm의 단백질-결합 시린지 필터로 시료를 여과했고(Pall Life Sciences), 각 단백질 시료는 동일한 완충액으로 투석했습니다. 이 완충액은 시린지와 셀에 상응하는 완충액을 배치하기 위해 부형제 용액을 전처리하는 데 사용했습니다.
제약품의 활성 성분으로 부형제를 직접 결합하는 경우 몇 가지 방식으로 제품에 영향을 미칠 수 있습니다. 최근 연구는 약학 제형에 일반적으로 사용되는 부형제는 활성 약물의 약동학 특성에 영향을 미칠 수 있음을 보여 줍니다(4, 5). 부형제는 잠재적으로 단백질 약물 구조 또는 생체이용률을 변경할 수 있으므로 약물 효능이 변하게 됩니다. 활성 성분의 약동학적 특성 또는 효능의 변화 이외에 부형제/단백질 상호 작용은 약품의 보관 수명 또는 안정성에 영향을 미칠 수 있습니다. 따라서 제형 부형제와의 단백질 상호작용을 인식하고 이해할 필요가 있습니다. 단백질과 용액 부형제 사이에서 직접적인 상호 작용을 감지한 경우 단백질 약물에 대한 제형을 설계하는 동안 두 가지 중요한 특징을 고려해야 합니다. 첫째, 단백질에 대한 부형제 결합의 강점 및/또는 가역성으로, 임상 투여 후 단백질 표면에 있는 주요 활성 부위를 가리거나 방해할 수 있습니다. 둘째, 비결합 부형제의 농도로, 원하는 솔루션 특성을 확보하기에 충분해야 합니다. 이러한 측면 각각은 ProX에 대해 아래에 예시되어 있습니다.
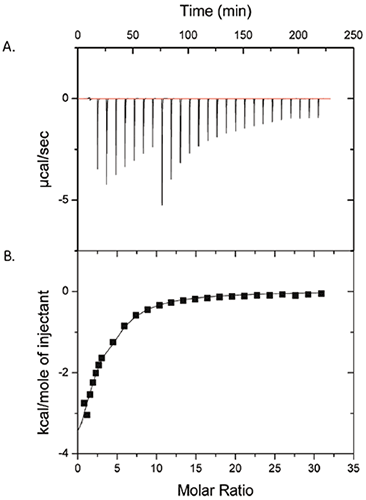
그림 1은 50mM의 폴리소르베이트-80을 25mg/mL ProX에 주입한 ITC 실험 결과를 보여 줍니다. 원시 데이터는 패널 (A)에 있고 대조 실행을 제거한 후 주입 당 통합된 열은 패널 (B)에 있습니다. 패널 (B)의 데이터는 폴리소르베이트-80과 ProX 사이에서 측정 가능한 상호작용이 존재함을 보여 줍니다. 결합 친화도 상수는 (KA) = 1430 ± 260 M-1이고 결합 엔탈피는 (ΔH) = -6.3 ± 1.1kcal/mol이며 ProX 분자당 결합 부위 수(n)는 2.6 ± 0.3인, 단일 부위 모델에 맞추어 데이터를 조정했습니다. 결합에 대한 엔트로피 변화(ΔS)를 계산한 결과 -6.7 ± 3.7 cal/mol-K로 나타났습니다.
|
등온선을 바탕으로(그림 1), ProX에 대한 폴리소르베이트-80 결합 부위는 약 10인 ProX 분자에 대한 폴리소르베이트-80의 분자비에서 포화되었음을 알 수 있습니다. 폴리소르베이트-80에 대한 임계 마이셀 농도(cmc)는 순수에서 0.012mM이고 단백질 용액에서 0.1mM만큼 높은 것으로 보고되었습니다(2). 그림 1의 ITC에서 폴리소르베이트-80 농도는 첫 주입 후에도 cmc 이상인 0.1 ~ 7mM 범위였습니다. 검출 가능한 상호 작용이 단량체가 아니라 계면 활성제 마이셀 입자에 대한 단백질 결합으로 인해 유발되므로 이 정보는 중요합니다.
제형 개발 시 결합 매개 변수를 파악하면 단백질을 '포화시키고' 안정화 효과를 얻기 위해 필요한 결합 부형제의 최저 농도를 측정할 경우 유용합니다. 제형에서 부형제 농도를 최소화하는 경우 환자에게 투여된 첨가제 수준뿐만 아니라 비용이 줄어듭니다. 이러한 특정 사례 연구에서 단백질 분자에 대한 폴리소르베이트-80의 10배 몰 초과 부분은 단백질을 포화하기에 충분합니다. 결합 매개 변수를 사용하여 생체 내에서 단백질-부형제 복합체의 거동을 예측할 수 있습니다. ITC로 측정한 결합 친화도 상수를 통해 ProX/폴리소르베이트-80 복합체가 단백질 약품의 생물학적 활성에 영향을 미치지 않고 혈류로 들어갈 때 희석으로 인해 분리됨을 알 수 있습니다.
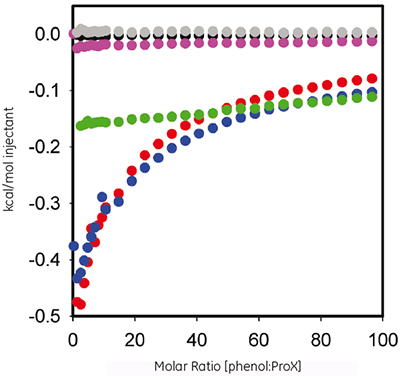
페놀은 ProX 제형에서 항미생물제로 사용됩니다. ITC를 사용하여 단백질과 방부제 간의 측정 가능한 결합의 열역학적 조건을 평가했습니다. 그림 2는 대조 실험을 제거한 후 pH 5.7, 4.5 및 3.5에서 10mg/mL ProX에 대한 60mM 페놀의 적정과 관련된 주입당 열 대 분자비를 플롯한 것입니다.
|
ITC 데이터는 pH 5.7 및 4.5인 ProX가 페놀과 상호 작용을 하지만 pH 3.5에서는 그렇지 않음을 보여 줍니다. 등온선은 미리 정의한 결합 모델에 맞추어 조정할 수 없으며, 결합 작용이 복잡하고 여러 부위와 관련되어 있음을 보여 줍니다.
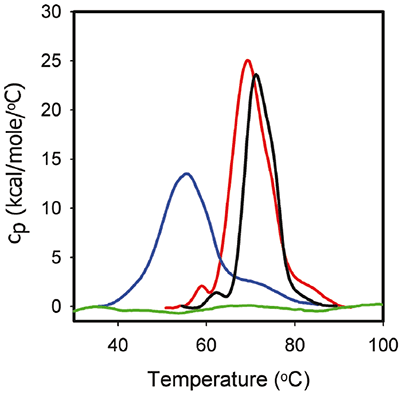
그림 3에는 ITC 실험에 사용된 것과 동일한 제형 완충액에서 1mg/mL ProX에 대한 DSC 추적을 수행한 내용이 나와 있습니다. 해당 DSC 데이터에 의하면 pH 5.7에서 페놀이 존재하지 않는 경우 ProX는 중간점 풀림 온도인 Tm1, Tm2, Tm3이 각각 59°C, 68°C 및 85°C이고 중간 전이가 주요 풀림 작용을 나타내는 최소한 세 가지 풀림 전이를 보여 줍니다. 풀림에 대한 총엔탈피(ΔHunf)는 270kcal/mol입니다. pH 4.5에서 첫 번째 전이는 검출할 수 없습니다. 주요 풀림 작용은 Tm2가 55°C와 동일하고 Tm3은 73°C로 저하되었습니다. ΔHunf는 216kcal/mol로 감소했으며 삼차 상호 작용의 강도 저하를 보여 줍니다. 마지막으로, DSC 데이터에서 검출 가능한 풀림 전이가 존재하지 않는 경우와 같이 pH 3.5에서 ProX는 산성 풀림 상태가 되었습니다.
|
그림 3에는 pH 5.7에서 페놀이 존재하는 경우의 ProX 풀림에 대한 DSC 서모그램이 나와 있습니다. 페놀로 인해 Tm1은 1°C, Tm2는 2°C로 증가했고 ΔHunf는 195kcal/mol로 감소했습니다. 그러나 ProX의 삼차 구조는 페놀이 존재하거나 존재하지 않은 경우 모두 동일했습니다(형광성과 같은 생물물리학적 특성 분석 데이터로 측정. 데이터 표시되지 않음). 대개, DSC 거동 변화는 다른 방법에 의해 구조 변화와 상호 연관될 수 있으나 항상 그렇지는 않습니다. DSC의 변화는 노출된 잔여물의 수화와 네이티브 단백질 구조(반 데르 발스, 소수성 및 정전기적 상호 작용, 수소 결합 등)를 안정화시키는 힘을 와해함으로써 발생하는 것으로 생각됩니다. 삼차 상호 작용의 불안정화는 단백질의 치밀도를 감소시킬 수 있고(DSC로 검출), 다른 분석 방법으로 검출 가능한 구조 변화를 유도하지 않습니다.
ITC 및 DSC 데이터를 조합한 결과 페놀-단백질 상호 작용에 대한 중요한 정보가 제시되었습니다. 첫째, 페놀은 접힌 ProX에 결합하지만 풀린 ProX에 결합하지 않습니다(그림 2). 따라서 페놀에 사용 가능한 결합 부위를 갖추려면 ProX의 삼차 구조를 온전하게 유지하는 것이 중요합니다. 둘째, 단백질의 삼차 구조가 기능상 온전한 것이 중요하므로 최적의 제형 pH는 pH 5.7입니다. 셋째, 그림 2에 나와 있는 ProX에 대한 페놀의 결합은 50보다 높은 분자비에서 완전한 포화 상태에 이릅니다. 넷째, 완전히 포화되지 않았지만 포화 상태에 근접한 38의 페놀 : ProX 분자 비로 DSC 시험(0.005%(v/v) 페놀이 포함된 pH 5.7 제형 완충액의 1mg/mL ProX)을 실시합니다. 다섯째, 결합 부위가 포함되지 않았지만 이 페놀의 분자비는 ProX의 열 안정성을 증가시키기에 충분합니다.
페놀은 ProX가 존재하는 경우 항균 작용이 저하된 것으로 나타났습니다(데이터 표시되지 않음). 페놀이 ProX에 결합하는 것을 파악한 후 관찰한 결과는 결합된 페놀은 결합되지 않은 페놀에 비해 항균 작용이 없거나 줄어드는 것을 보여 줍니다. 결합 곡선을 참고하여, 결합되지 않은 페놀의 농도로 인해 효과적인 향균 작용이 가능한 경우 제형에 따라 포화-결합 지점의 페놀 농도를 선택할 수 있습니다. 페놀이 존재하는 경우 ProX의 Tm 값이 증가하는 것을 초기에 예측하지 못했으나, 이 증가한 값은 향상된 열 안정성을 나타내고 단백질의 장기 안전성을 보여 줍니다. 페놀-유도 안정화와 페놀의 항균 효과 사이에는 직접적인 연관성이 없을 수 있습니다.
ITC와 DSC를 사용하여 pH 5.7의 접힌 ProX에 대한 페놀 결합과 ProX에 대한 폴리소르베이트-80의 결합을 확인하고 열역학적인 특성을 분석했습니다. 폴리소르베이트-80에 대한 ProX의 측정된 결합 상수를 통해 해당 상호 작용을 약한 상호 작용으로 분류하고, 단백질 약물의 생물학적 영향 및 최소한의 부형제 유도 간섭과 함께 제형에 있는 안정화된 부형제에서 활성 단백질이 해리(생체 내 해리)되는 것을 예측할 수 있습니다. 최적의 항균 기능과 향상된 열 안정성을 가진 제형을 생성하기 위해 ProX-페놀 적정에 대한 포화 곡선에 따라 포화 지점 이상의 페놀 농도를 파악합니다. 가정된 부형제 결합을 확인할 뿐만 아니라 두 가지 부형제(cmc 보다 높은 농도에서 ProX 분자에 대한 폴리소르베이트-80의 10배 몰 초과 부분 및 ProX 분자에 대한 페놀의 50배 몰 초과 부분)의 적절한 부형제 농도를 식별했습니다.
단백질 제품 제형에 대한 요건에는 안정성과 효율성이 포함됩니다. 안전하고 효율적인 단백질 치료법을 만들고 제품 안정성과 보관 수명을 개선하기 위해 부형제를 추가하는 경우 분자 수준에서 부형제와 단백질의 상호 작용을 파악해야 합니다. 이 응용 노트에서는 ITC와 DSC를 사용하여 복합 단백질 용액 제제에서 여러 상호 작용 중의 하나로 단백질-부형제 결합을 분석했습니다.
Arakawa, T., et al, Factors affecting short-term and long-term stabilities of proteins(단백질의 단기 및 장기 안정성에 영향을 미치는 요소). Adv. Drug Deliv. Rev. 46, 307-326(2001).
Chou, D. K., et al, Effects of Tween 20 and Tween 80 on the stability of Albutropin during agitation(교반 동안 Albutropin의 안정성에 대한 Tween 20과 Tween 80의 효과). J. Pharm. Sci. 94, 1368-1381(2005).
Bam, N. B., et al, Tween protects recombinant human growth hormone against agitation-induced damage via hydrophobic interactions(Tween은 소수성 상호 작용을 통해 교반 유도 손상에 대해 재조합형 인체 성장 호르몬을 보호한다). Pharm. Sci. 87, 1554-1559(1998).
Ren, X., et al, 제약 부형제는 체계적인 관리 후 무세포계에서 시토크롬 P450 활성을 억제한다. Eur. Jour. Pharm. Biopharm. 70, 279-288(2008).
Taheri-Kafrani, A., et al, T. Beta-lactoglobulin structure and retinol binding changes in presence of anionic and neutral detergents(음이온 및 중성 세제가 존재하는 경우의 베타-락토글로불린 구조와 레티놀 결합 변화). J. Agric. Food Chem. 56, 7528-7534(2008).