이 응용 노트에서는 프리포뮬레이션 개발에서 완충액을 신속하게 검사하고 공정 개발 동안 항체의 보관 상태를 최적화하기 위해 Malvern MicroCal VP-Capillary DSC를 사용했습니다. 이 결과는 시간이 많이 들어가는 방법으로 얻은 결과와 거의 일치합니다.
질환을 치료하기 위해 항체 및 다른 단백질 분자와 같은 바이오치료제를 사용하는 분야가 제약 산업에서 급속하게 성장하고 있습니다. 바이오치료제는 높은 농도로 여러 번 복용해야 하므로 제조업체는 킬로그램 수량 또는 더 많은 단백질 약품을 생산해야 합니다. 바이오치료제의 제조 공정은 정제 공정 후 대규모 크로마토그래피 컬럼과 수천 리터의 생물 반응 장치 매질의 단백질 발현과 관련되어 있습니다.
공정 조건에 대한 단백질 안정성, 구조적 변화의 가역성 및 응집 성향은 pH 및 완충액 조성과 같은 요소에 따라 달라집니다. 이러한 요소를 철저히 파악하는 것은 분석 방법의 개발과 포뮬레이션, 공정 조건의 선택에 중요합니다. 단백질을 불안정하게 만들 수 있는 항체 정제 공정의 단계에는 최종 포뮬레이션을 포함하여 단백질 A 컬럼의 낮은 pH 용리 단계, 바이러스 불활화에 대한 낮은 pH 유지 단계 및 pH 및/또는 이온 강도 조절과 관련된 단계 등이 포함됩니다.
시차 주사 열량측정법(DSC)은 열 전이 중간점(Tm)을 모니터링하여 다른 pH 및 공용성 조건에 따라 단백질의 열 안정성에 대한 정보를 제공합니다. 높은 Tm은 높은 안정성을 반영하고 이는 장기 안정성과 상관되어 있습니다. 이 응용 노트에서는 Diosynth Biotechnology가 제조 공정에 사용된 낮은 pH 바이러스 불활화의 최적화와 프리포뮬레이션 개발을 진행하고 초기 pH 및 완충액 검사 동안 항체 안정성을 분석하기 위해 DSC에서 얻은 열 안정성 데이터를 어떻게 사용하는지를 설명합니다. 단백질 안정성 저하를 유발하지 않는다면 낮은 pH 바이러스 불활화는 단백질 제조에 바람직한 상태입니다.
DSC 작업은 Malvern MicroCal VP-Capillary DSC 시스템을 사용하여 수행했습니다. 프리포뮬레이션 개발 연구에서 pH 3 ~ 8의 다양한 완충액을 사용했습니다. 단백질(항체 X)은 각 완충액에 보관하고 보관한지 1주 후(t = 1주) 분석을 즉시 수행했습니다(t = 0).
정제 조건의 최적화를 위해 항체 Y의 DSC 서모그램(pH 7.4인 NaCl 과 EDTA가 포함된 중성 트리스 완충액)을 연구하고 pH 9.0인 2 M 트리스를 사용하여 pH 6로 조정한 구연산염 완충액 및 pH 3 구연산염 완충액과 비교했습니다.
완충액에 대한 서모그램은 MicroCal VP-Capillary DSC 분석 프트웨어에 장착된 Origin™ 7.0 소프트웨어를 사용하여 분석 전 각 단백질에서 제거했습니다.
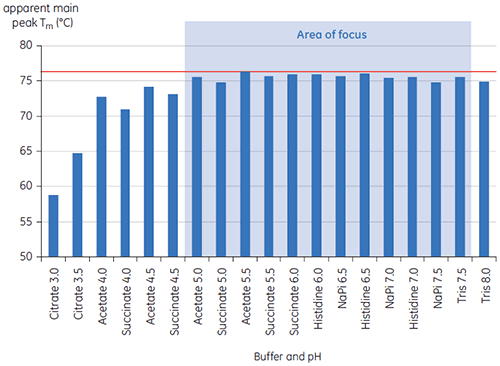
프리포뮬레이션 개발을 위한 19개 완충액의 초기 연구에서 항체 X 에 대해 t = 0인 경우의 주요 Tm 피크 값은 그림 1에 나와 있습니다. 이 두 가지 완충액에서 항체에 대한 DSC 서모그램은 그림 2에 나와 있습니다. Tm 값에서 가장 안정적인 완충액 조건은 pH 5.0 ~ pH 7.5에서 발견되었습니다. t = 0에서 다른 분석 방법(UV, 크기 배제 크로마토그래피(SEC), 광 산란, 및 SDS-PAGE)은 DSC에 비해 완충액 조건에 대한 식별력이 훨씬 떨어지는 것으로 나타났습니다(데이터 표시되지 않음).
|
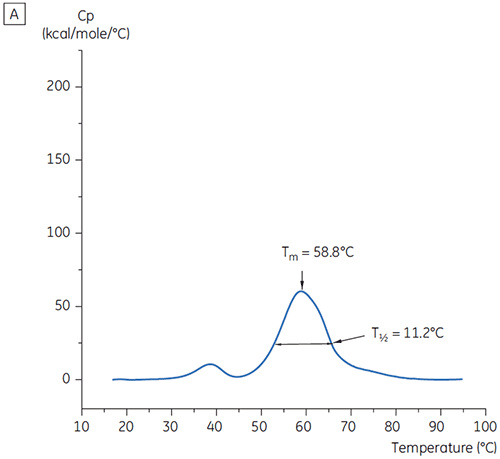
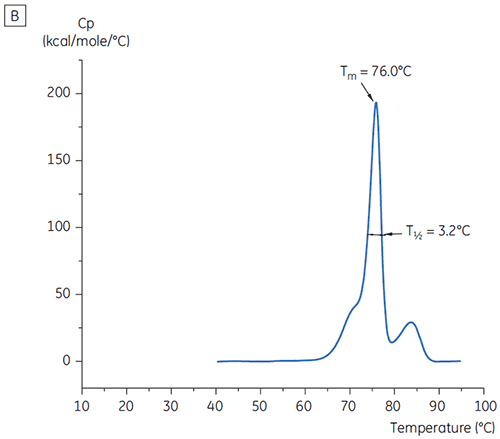
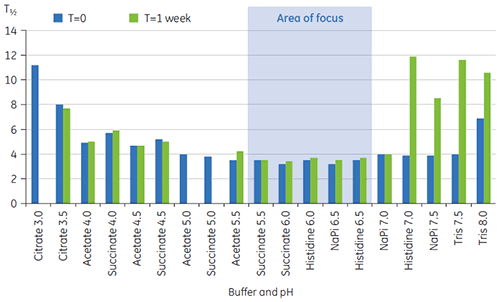
그림 2에 표시된 조건을 구별하기 위해 T½ 값을 사용했습니다. T½는 DSC 서모그램에 있는 주요 전이의 최대 절반 높이에 대한 피크 폭이고 열 전이의 공동성을 반영합니다. 낮은 T½ 값은 작은 구조를 나타내고 포뮬레이션과 관련하여 선호됩니다. 최저 T½ 값은 PH 5.5 ~ 6.5인 완충액에서 발견되었습니다(그림 3).
|
|
|
pH 3인 구연산염 완충액은 바이러스 불활화에 대한 낮은 pH 유지 단계와 단백질 A 친화도 컬럼에서 항체의 용리에 사용하기 위한 후보 물질입니다. 대다수 단백질은 낮은 pH에 장기적으로 노출되면 불안정해지므로 바이러스 불활화 단계 후 pH를 즉시 상승시켜야 합니다.
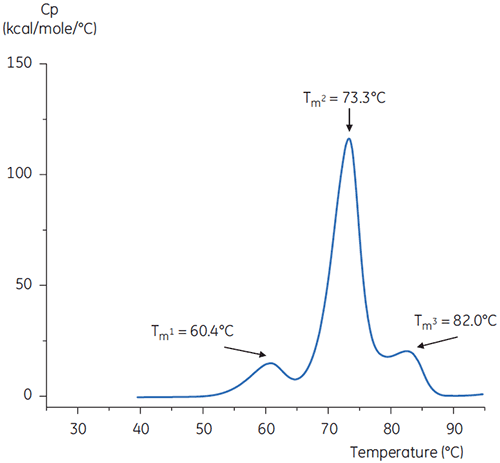
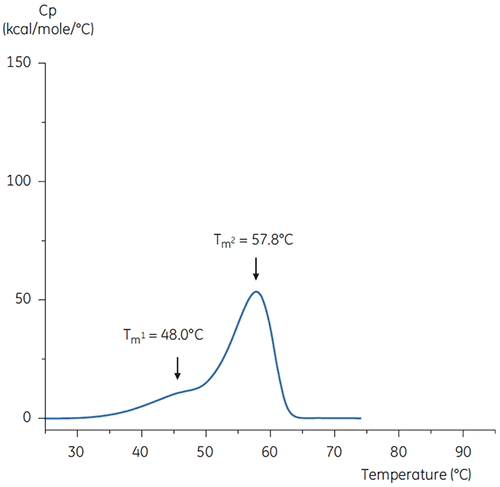
중성 pH 및 pH 3인 완충액의 항체에 대한 DSC 스캔은 그림 4 및 5에 나와 있습니다.
|
|
두 서모그램의 형상과 패턴의 차이는 pH 3.0 완충액의 항체에 대한 열 안정성 손실을 보여 줍니다. Tm2 전이의 피크 높이가 낮고 피크가 광범위하며 pH 3.0의 일차 전이와 이차 전이 간의 선명도가 pH 7.4에 비해 두드러지지 않습니다.
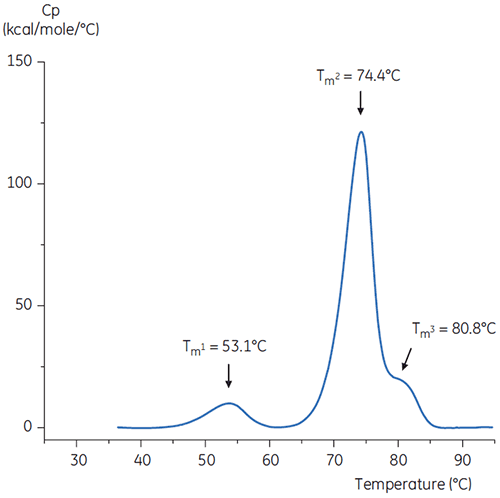
pH 중화 단계를 답습하기 위해 pH 9인 농축된 트리스 용액을 사용하여 항체 용액의 pH를 pH 6.0으로 조절했습니다. 이 결과로 생성된 항체 용액의 서모그램은 그림 6에 나와 있습니다. 여기서, pH 3.0 완충액의 항체에 비해 열 안정성이 증가된 것으로 보입니다. pH 6.0 용액의 항체에 대한 Tm2 및 Tm3은 기준 완충액의 항체에 대한 Tm2 및 Tm3과 유사합니다. pH 6 항체의 전체 형상, 피크 선명도 및 피크 폭은 pH 7.4의 기준 상황과 유사합니다.
히스티딘과 같이 안정화 부형제가 존재할 경우 중화를 수행할 수 있습니다. 이 경우 히스티딘이 존재할 때 중화된 항체의 서모그램은 그림 6과 동일했고 이 특정 항체에 대해 히스티딘은 유의한 안정화 효과를 제공하지 못하는 것으로 나타났습니다.
|
이 연구는 DSC를 사용하여 프리포뮬레이션 개발에 대한 pH 및 완충액 조건을 신속하게 최적화할 수 있음을 보여 줍니다. 이러한 데이터는 탐색 조건의 수를 상당히 줄이면서 후속 부형제 검사에 적절한 완충액 및 pH 간격에 대한 순위를 매기는 데에 사용했습니다.
DSC를 사용하여 낮은 pH 불안정화 유지 단계와 pH 3.0에서 6.0으로 조절하는 다음 단계 동안 항체의 안정성을 확인할 수 있습니다. 이런 종류의 안정성 정보는 바이오 의약 제조 공정을 설계하고 최적화하는 데에 유용합니다.
이 데이터는 Dr Kathrine E Bowers(FUJIFILM Diosynth Biotechnologies USA Inc.)가 제공했습니다.