이 문서는 이 기법으로 여러 영역 단백질에서 개별 영역의 안정성을 검사하고 항체와 다른 단백질에 대한 공정 개발을 안내하는 방법을 설명합니다.
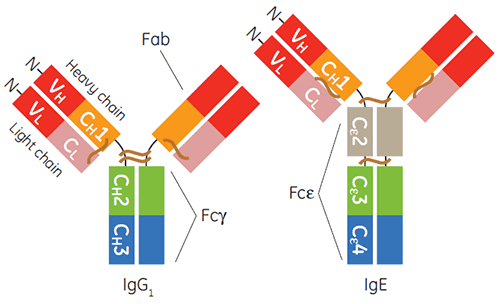
진단 또는 치료 응용 분야를 위한 감마 아이소타입(특히, 인간 IgG1)의 면역글로불린 생산 및 정제는 현재 상당히 일반화되어 있습니다. 지난 10년간 IgE 기반 치료법 개발에 탄력이 붙기 시작했습니다(1-3). IgE는 인체 방어를 위한 염증과 기생충 감염에 대한 숙주 방어에 중요합니다. 수용체를 통한 IgE 매개성 신호는 염증을 유발하는 알레르기성 질환의 중점 사항이기도 합니다(4). IgE의 일정한 영역은 이중 쌍의 Ig 접힘 영역 3개(Cε2, Cε3 및 Cε4)가 포함된 호모다이머이고 두 수용체, FcεRI 및 CD23(FcεRII로 알려짐)의 결합을 담당합니다(그림 1).
이 응용 노트에서는 IgG 및 IgE에 대한 여러 측면의 바이오치료법 개발 공정 정보를 제공하기 위해 시차 주사 열량측정법(DSC)의 유용성을 집중적으로 다룹니다. DSC는 표지 또는 인공 프로브를 사용하지 않고도 단백질 풀림을 신속하게 연구할 수 있습니다. 이 기법은 단백질이 풀림에 따라 시료에서 흡수한 열을 확인하고 열 안정성을 측정한 다음 장기 안정성을 파악합니다.
특히 여기에 설명된 작업에서는 DSC가 IgG 및 IgE 약품의 처리, 정제 및 포뮬레이션에 대한 이해를 돕고 있음을 알 수 있습니다. 이러한 결과에 기여한 원편광 이색성 분광 측정법(CD)의 기능은 DSC로 식별할 수 있는 것과 대비됩니다. DSC는 CD로 얻은 데이터에서 덜 투명한 측면인 여러 영역 단백질 내의 개별 영역 수준에서 단백질 안정성을 조사할 수 있습니다.
|
이 실험은 Malvern MicroCal VP-Capillary DSC를 사용하여 실시했습니다.
정제된 Fcε, Fcγ 및 Fcγ-Cε2 단백질이 앞에서 설명한 대로 생성되었습니다(5). 다른 pH 값에서 400개 이상의 스캔 작업이 이루어진 capillary DSC 실험은 별다른 어려움 없이 4개월 동안 진행되었습니다. 단백질 농도, 희석도 및 플레이트 설치를 포함하여 Fcε 및 Fcγ에 대한 실험을 설정하는 데 약 3시간이 걸렸습니다. 실험의 나머지 부분은 MicroCal VP-Capillary DSC의 자동화 기능을 통해 실시했습니다. 전체 내용이 (5)에 자세히 설명되어 있습니다.
광범위한 pH/염 안정성은 산업 현장에서 적용하는 친화성 단백질 정제 공정에 대한 필수 요건입니다. 비정상적인 pH 또는 염 조건에 대한 허용 오차가 낮으면 응집되거나 비기능적인 단백질이 생성될 수 있습니다. 다양한 pH/염 조건에 대한 Fcε 허용 오차는 IgE/Fcε 함유 단백질의 적절하고 확장 가능한 정제도를 측정하기 위한 중요한 정보입니다. Fcε의 이차 구조에 미치는 pH 영향을 연구하기 위해 pH 4.5 ~ 7.4 범위의 완충액 조건에 따라 CD 스펙트럼을 획득했습니다.
pH 5.2 ~ 7.4인 Fcε 스펙트럼은 동일하고 216nm ~ 217nm의 단일 최소값이 포함되어 있으며 중요한 β 면과 Ig 영역을 나타냅니다. pH 5에서 Fcε 스펙트럼은 불규칙 나사선 방향으로 변화하고(200nm로 최소 변화) pH 4.5에서 이 스펙트럼은 단백질이 불규칙 나사선 구조임을 보여 줍니다(5). pH에 따른 풀림을 기반으로 Fcε가 pH 7.0 ~ 4.5에서 감쇠 안정성이 있는지를 조사했습니다.
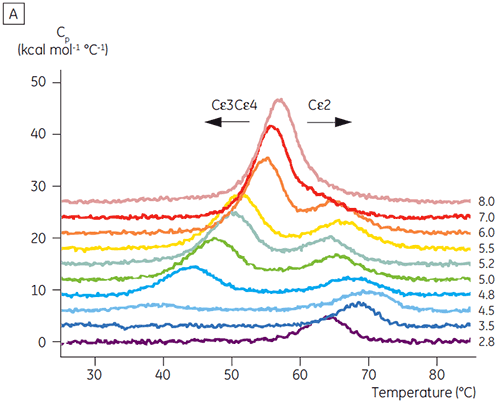
다양한 pH 값에서 Fcε의 열 변성을 원거리 자외선 CD로 모니터했습니다. pH 7.0에서 세 영역(Cε2-4) 풀림에 대해 한번의 전이가 일어났습니다. 겉보기 Tm이 1°C 감소했지만 pH 6.0에서 유사한 전이가 관찰되었습니다. pH 5.2에서 Fcε의 열 풀림은 중성 pH에서보다 6°C나 낮은 온도에서 시작되는 광범위한 전이를 유발했습니다. pH 4.8에서만 두 번의 전이가 분명하게 확인되었습니다(5).
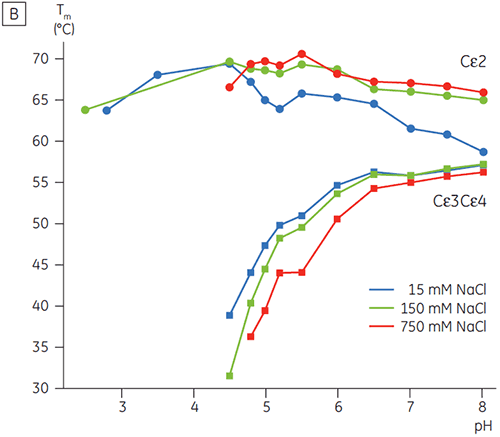
초기 CD 결과를 바탕으로 DSC를 사용하여 Fcε 및 Fc γ에 대해 자세한 pH에 따른 안정성 연구를 시작했습니다. Fcε 및 Fcγ의 풀림 전이는 비가역적이고 주사 속도에 따라 다른 것으로 판명되었고 비가역 응집이 두 단백질의 겉보기 Tm 값에 영향을 미침을 알 수 있습니다(6,7). CD를 사용하여 측정할 수 있는 것과는 달리, Fcε는 8.0 이하의 pH 값에서 2개의 독립적인 풀림 전이를 포함하고 있는 것으로 나타났습니다(그림 2A). 이러한 전이 중의 하나가 낮은 pH와 높은 NaCl 농도에서 불안정화된 반면, 다른 하나는 불안정화되지 않았습니다.
|
|
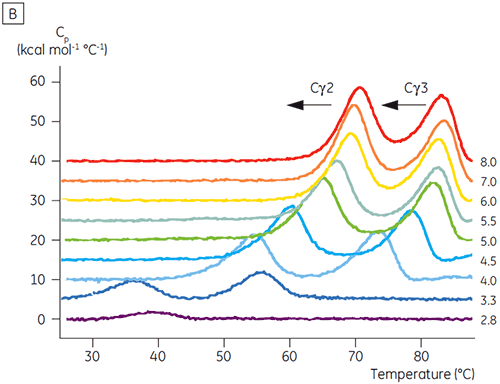
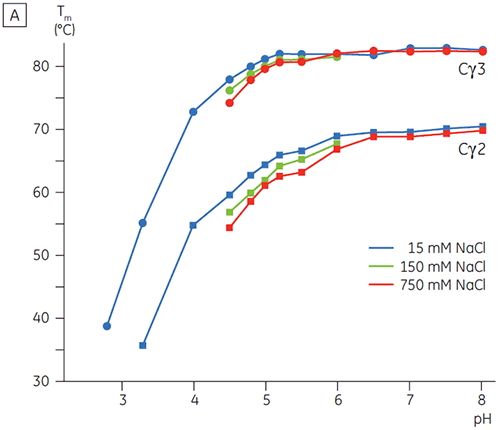
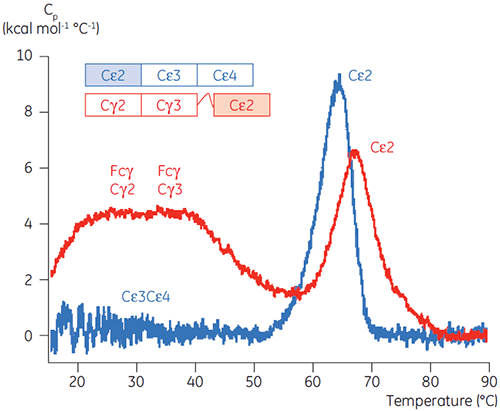
pH에 민감한 전이와 관련된 영역은 CD로 얻은 구조 데이터를 토대로 예상한 것과 같이 pH 4.5에서 완전히 풀리고, DSC가 접힌 영역의 안정성뿐만 아니라 접힌 상태를 파악하는 데에도 얼마나 중요할 수 있는지를 보여 줍니다. Fcγ(IgG1)는 Cγ2 영역에 속하는 낮은 온도 전이와 Cγ3 영역에 속하는 높은 온도 전이 등 두 개의 별도 전이를 통해 풀리는 것으로 나타났습니다(그림 2B). Cγ2 전이는 데글리코실화가 열 안정성에 미치는 영향으로 파악했고(공개되지 않은 결과), Cγ3 전이는 비정상적으로 높은 열 안정성으로 파악했습니다(8). 두 Fcγ 영역은 pH와 NaCl에 민감한 것으로 나타났습니다. Fcε와 달리, Fcγ 영역은 pH가 3.0 이하로 감소할 때까지 본질적으로 풀리지 않으며, 항체가 3.5 이하의 pH 값에서 단백질 A 매질에서 용리되는 이유와 양이온 교환 크로마토그래피가 IgG에 적절한 정제 기법이 될 수 있는 이유를 보여 줍니다(그림 3).
|
|
고농도 염이 있는 경우 Fcγ의 Cγ2 및 Cγ3 영역과 Fcε의 Cε3 및 Cε4 영역은 불안정화되었습니다. 5.0 ~ 7.0의 중간 물질 pH 범위에 있는 15mM NaCl에 비해 150 ~ 750mM NaCl에서 Tm 값이 조금 변경(그림 3A)된 것으로 나타났습니다. 두 Cγ2 및 Cγ3 영역의 Tm 값이 60°C 이상이므로 작은 안정성 차이는 이 pH 범위 내에서 Fcγ의 체외 반감기에 중요한 영향을 미치지 않을 것으로 보입니다.
Fcγ-Cε2 융합 단백질로 DSC 실험을 실시하여 Fcε의 pH에 민감한 영역이 수용체 결합 영역(Cε3 및 Cε4)임을 확인했습니다. Fcγ-Ce2 및 Fcε의 한 영역은 pH 2.5에서 안정되게 접혀 있습니다(그림 4). 위에서 설명한 실험을 토대로, Fcγ 영역은 pH 3.0 이하에서 본질적으로 풀림을 알 수 있습니다. 기본적으로 Fcε의 Cε2 영역은 pH에 민감한 영역으로 식별되었습니다. 이 결과는 pH 4.5에서 Fcε의 제한된 단백질 가수 분해를 통해 확인했습니다(5).
|
고농도 염에서 Fcε의 Cε2 영역은 약간 더 열안정적이었습니다. 특히 Cε2는 15mM NaCl에서 측정한 Tm보다 높은, Tm이 7°C 이상인 중성 pH 및 750mM NaCl에서 안정화되었습니다(그림 3B). 반면에, NaCl로 인해 pH 5 ~ 6인 Cε3Cε4 영역이 상당히 불안정해졌습니다(그림 3B). Cε3Cε4는 저농도 염 및 pH 5.0에서 풀리기 시작했습니다. 고농도 염에서 풀림 전이는 0.5 pH 단위에서 pH 5.5로 변경되었고 양이온 교환 크로마토그래피를 단백질이 포함된 IgE 또는 Fcε의 실행 가능한 정제 단계로 사용하지 못했습니다.
이 연구에서 Fcε는 Fcγ에서 관찰한 것(pH 5.0)보다 높은 2 pH 단위에서 수용체 결합 영역의 풀림을 유발하는 비정상적인 pH 감도를 나타냈습니다. DSC로 측정한 Fcε의 pH/염 감도는 IgE 기반 단백질에 대한 제형, 처리 절차 및 정제 전략을 선택하는 데에 유용한 정보를 제공하고 표준 IgG 프로토콜은 처리하기가 쉽지 않음을 보여 줍니다. Fcγ에 대한 pH 안정성 데이터는 낮은 pH 용리가 포함된 표준 친화성 정제 공정(단백질 A 매질에 가장 일반적으로 사용됨) 동안 IgG 시간 의존 응집에 대한 유용한 방법을 제공합니다.
이 응용 노트는 Dr Stephen Demarest(Biogen Idec, San Diego CA)가 제공했습니다.
1. Zhu, D. et al. A novel human immunoglobulin Fcγ Fcε bifunctional fusion protein inhibits Fcε RI-mediated degranulation(새로운 인간 면역글로불린 Fcγ Fcε 이작용기 융합 단백질은 Fcε RI-매개성 탈과립을 억제한다). Nature Med. 8, 518–521(2002).
2. Zhu, D. et al. A chimeric human-cat fusion protein blocks cat-induced allergy(키메라 인간-고양이 융합 단백질은 고양이 유도 알레르기를 차단한다). Nature Med. 11, 446–449(2005).