이 응용 노트에서는 흡수, 분해, 신체 배출의 속도와 효능을 확인하기 위해 NTA(나노 입자 추적 분석)를 사용하여 리포좀과 같은 약물 전달에 사용된 나노 입자의 크기와 농도를 측정하는 방식에 대해 논의합니다.
약물 전달에 나노 입자를 사용하는 사례가 빠르게 증가하고 있습니다. 나노 입자는 뛰어난 약동학적 특성, 지속적이며 제어된 방출, 그리고 특정 세포, 조직 또는 기관 표적화가 가능합니다. 나노 입자 약물 전달이 많은 주목을 받게 된 것은 질병 치료를 위해 치료법으로 활용 가능한 새로운 생물학적 활성 화합물의 발견 속도가 둔화되었기 때문이기도 합니다. 매년 시장에 소개되는 신약의 수가 감소하면서 약물 전달을 위해 나노 입자의 다목적, 다기능적 구조 이용에 대한 관심이 빠르게 증가하고 있습니다. 이러한 모든 특징은 기존 약물의 효능을 향상시킬 수 있습니다(Malam 외, 2011).
약물 전달에 사용된 나노 입자는 다양한 조성의 다양한 물질로 만들 수 있는 1마이크론 미만의 콜로이드로 정의되어 졌습니다. 일반적으로 정의된 나노 입자 벡터에는 리포좀, 마이셀, 덴드리머, 고체 지질 나노 입자, 금속 나노 입자, 반도체 나노 입자, 고분자 나노 입자 등이 있습니다. 나노 입자는 다양한 방식으로 특정 세포 또는 조직에 약물, 유전자, 백신, 진단하기 위하여 광범위하게 채택되어 왔습니다. (Ram 외, 2011).
나노 물질 약물 전달 체계를 고려할 때 나노 입자의 크기는 전달, 흡수, 분해, 신체로부터의 배출에 직접적으로 영향을 미치기 때문에 주요 매개 변수입니다. 예를 들어, 직경이 30nm부터 수백 nm까지의 나노 입자는 누출되는 혈관 구조로 인해 종양 부위에서 수동적으로 축적될 수 있고, 식세포 활동은 >500nm 입자를 선호하는 반면, 담관에서는 <30nm, 신장에서는 <8nm의 입자는 축적되지 않고 투과됩니다. 또한, 간은 큰 입자(200nm 및 300nm)에 비해 작은 입자(25nm 및 50nm)를 적게 흡수합니다. 따라서 여러 체계와 프로세스에 따라 투여하는 입자의 크기를 정확하게 측정하는 것이 중요합니다.
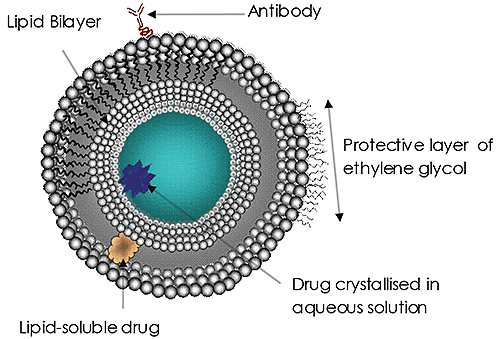
리포좀(그림 1)은 여러 해 동안 활발히 연구 및 개발되어 왔으며 현재 가장 일반적인 표적 약물 전달 체계입니다. 리포좀은 진균성 또는 원생동물 감염의 암포테리신 B, 유방암 치료의 독소루비신, A형 간염 및 인플루엔자 백신의 전달 체계로 승인되었습니다. 전달 체계에서 리포좀의 사용과 잠재성에 대한 중요성이 계속 증가하고 있습니다. 그 이유는 분명합니다.
사용된 리포좀의 크기는 치료 효능의 중요한 요소로 점점 더 중요하게 인식되고 있습니다. 약물 전달 리포좀의 크기는 혈액에서 해당 순환 및 잔류 시간, 표적의 효능, 세포 흡수 속도(또는 세포 이물 흡수)등에 영향을 미치고, 결과적으로 해당 양을 성공적으로 방출하는 데 영향을 미칠 수 있습니다. 이와 같은 크기에 대한 고찰은 모든 나노 크기 약물 전달 체계에 매우 중요합니다.
|
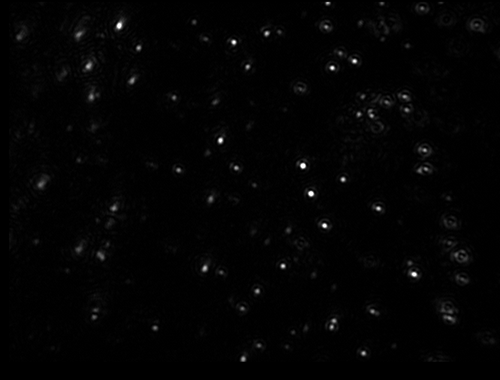
말번의 NanoSight 장비는 물 및 기타 용매에 들어 있는 리포좀의 크기와 농도를 빠르고 정확하게 측정합니다. 소량과 최소한의 시료 전처리만 필요합니다. 이 장비를 사용하면 현탁액 중 리포좀을 개별적으로 시각화하고 해당 브라운 운동을 추적하여 몇 초 이내에 입자 크기 분포를 확인할 수 있습니다.
|
NTA는 크기 및 농도 이외에도 다음의 매개 변수별로 입자 정보를 제공할 수 있습니다.
PBAE(폴리 β-아미노 에스테르)는 다양한 암을 치료하기 위한 유전 치료의 전달 체계가 될 수 있습니다. PBAE는 조합 경로를 통해 DNA와의 다양한 고분자 결합이 가능하다는 점에서 다른 체계보다 뛰어난 장점을 제공합니다. 또한 가수 분해로 인한 빠른 방출 속성을 갖고 있지만, 이로 인한 복용량의 변화와 생산 및 보관에 대한 문제가 발생합니다. 냉동 건조가 일반적 보관 방법이며 PBAE-DNA 나노 입자의 응집(크기 증가) 및 파괴(크기 감소)에 대해 냉동 건조가 미치는 영향을 평가하는 데 NTA가 활용되었습니다(Tzeng 외 2011 및 Sunshine 외 2012).
PLGA(폴리-락틱-코-글리콜산)는 FDA에서 승인한 약물 전달 체계입니다. PLGA는 젖산과 클리콜산으로 분해되며, 둘 다 신체에서 대사 경로의 최종점입니다 PLGA는 아목시실린뿐만 아니라 진행된 전립선 암의 치료를 위한 성선자극호르몬 방출호르몬의 약물 전달 체계로 사용되어 왔습니다. 복용 수준을 줄이고 그에 따른 독성 부작용을 줄이기 위해 면역 억제 마이코페놀산을 PLGA에 캡슐화했습니다. 올바른 전달을 보장하고 연구자들이 연구 간 결과를 비교하는 데 중요한 매개 변수인 나노 입자의 크기를 확인하는 데 NTA가 사용되었습니다(Shirali 외 2011).
세포막 사이에서 분자를 성공적으로 이동하는 것이 전달의 핵심입니다. 분자만으로는 세포막을 침투할 수 없는 경우가 대부분이기 때문에 효율적 전달체가 필요합니다. Sokolova 외 여러 명(2012)은 NTA, DLS(동적 광산란), EM(전자 현미경)을 사용하여 세포막 사이에서 크고 작은 분자의 다목적 전달체로 인산칼슘(직경: 100nm - 250nm, 기능화에 따라 다름)을 조사했습니다.
Ohlsson 외 여러 연구진(2012)은 리포좀의 안정성과 무결성을 확인하기 위해 NTA를 사용하여 개별 프로테오리포좀의 지질 이중층 세포막 사이에서 100밀리초 미만의 시간 동안 용질 이동에 대해 보고하였습니다.
Ghonaim과 동료는 유전 전달 수단으로서의 나노 입자에 대한 연구에서 리포폴리아민 및 스페르민의 화학에 대한 수정이 다양한 비 바이러스 플라스미드 DNA 및 siRNA 전달 체계에 미치는 영향에 대해 광범위하게 보고했습니다(Ghonaim 외, 2007a, Ghonaim 외, 2007b, Ghonaim 외, 2007c, Ghonaim, 2008, Ghonaim 외, 2009, Soltan 외, 2009, Ghonaim 외, 2010). 마찬가지로, Ofek 외 여러 연구진(2010)은 siRNA 전달의 수지상 나노 전달체의 특성 분석을 위해 NTA를 채택했으며 Bhise는 세포 배양의 유전 전달 중합체 연구에서 NTA를 이용하여 입자 크기와 크기 분포를 측정했습니다(Bhise 외, 2010). Bhise는 최근 고분자 나노 입자로 캡슐화된 플라스미드 수를 정량화하기 위한 분석을 개발하기 위해 이 연구를 확대하고 NTA를 사용하여 100nm 나노 입자당 플라스미드 밀도 수를 측정했습니다(Bhise 외, 2011).
Wei 외 연구진(2012)은 나노 약물을 개발하고 발전시키기 위하여 나노 입자의 크기, 모양, 구성의 정확한 특성 분석을 위한 견고한 방법 뿐만 아니라, 비특이성 세포 독성을 낮은 수준으로 유지하고 보관 중 안정성을 향상하기 위한 입자 엔지니어링에 대한 필요성을 확인했습니다.
NTA를 이용한 나노 입자 약물 전달 체계의 크기 측정 및 전달의 다른 예들도 보고되었습니다(Hsu 외, 2010, Park 외, 2010, Tagalakis 외, 2010).
1. Bhise NS, Gray RS, Sunshine JC, Htet S, Ewald AJ, Green JJ(2010) The relationship between terminal functionalization and molecular weight of a gene delivery polymer and transfection efficacy in mammary epithelial 2-D cultures and 3-D organotypic cultures(유선 상피 2-D 배양 및 3-D 기관형 배양에서 터미널 기능화, 유전 전달 고분자의 분자량, 트렌스펙션 효능 간 관계), Biomaterials, doi:10.1016/j.biomaterials.2010년 7월.023
2. Bhise NS, Shmueli RB, Gonzalez J, Green JJ(2011), A Novel Assay for Quantifying the Number of Plasmids Encapsulated by Polymer Nanoparticles(고분자 나노 입자로 캡슐화된 플라스미드 수 정량화를 위한 새로운 분석). Small. doi: 10.1002/smll.201101718
3. Ghonaim HM, (2008) Design and Development of Pharmaceutical Dosage Forms for Gene and siRNA Delivery(유전 및 siRAN 전달을 위한 약품 복용 형태의 설계 및 개발), 배스 대학교 약학부 박사 논문, 2008년 9월
4. Ghonaim HM, Li S 및 Blagbrough IS(2010) N1,N12-Diacyl Spermines: SAR Studies on Non-viral Lipopolyamine Vectors for Plasmid DNA and siRNA Formulation Pharmaceutical Research(N1, N12-다이아실 스페르민: 플라스미드 DNA 및 siRNA 제형 제약 연구를 위한 비 바이러스 리포폴리아민 벡터에 대한 SAR 연구), 볼륨 27,(1) 17-29페이지
5. Ghonaim HM, Li S, Soltan MK, Pourzand C, Blagbrough IS(2007a), Chain Length Modulation in Symmetrical Lipopolyamines and the effect on Nanoparticle Formulations for Gene Delivery(대칭 리포폴리아민의 체인 길이 조정 및 유전 전달을 위한 나노 입자 제형에 미치는 영향), 영국 약학 컨퍼런스 BPC2007, 맨체스터, 9월 10일
6. Ghonaim HM, Li S, Pourzand C, Blagbrough IS(2007b), Efficient Novel Unsymmetrical Lipopolyamine Formulations for Gene Delivery(유전 전달을 위한 효율적 신종 비대칭 리포폴리아민 제형), 영국 약학 컨퍼런스 BPC2007, 맨체스터, 9월 10일
7. Ghonaim H M, Li S, Pourzand C, Blagbrough IS(2007c), Formulation and Delivery of Fluorescent siRNA by Lipospermine Nanoparticle Complex Formation(리포스페르민 나노 입자의 복잡한 형성에 의한 형광 siRNA의 제형 및 전달), 영국 약학 컨퍼런스 BPC2007, 맨체스터, 9월 10일
8. Ghonaim H, Li S, Blagbrough IS(2009) Very Long Chain N4 , N9 -Diacyl Spermines: Non-Viral Lipopolyamine Vectors for Efficient Plasmid DNA and siRNA Delivery Pharmaceutical Research(매우 긴 체인 N4, N9 - 다이아실 스페르민: 효율적 플라스미드 DNA 및 siRNA 전달 약학 연구를 위한 비 바이러스 리포폴리아민 벡터), 볼륨 26, 1번, 19-31페이지
9. Hsu J, Serrano D, Bhowmick T, Kumar K, Shen Y, Kuo Y C, Garnacho C, Muro S(2010) Enhanced Endothelial Delivery and Biochemical Effects of α-Galactosidase by ICAM-1-Targeted Nanocarriers for Fabry Disease(파브리병을 위한 ICAM-1-표적 나노 전달체에 의한 α-갈락토시다아제의 내피 전달 및 생화학 효과 향상) Journal of Controlled Release, 매체 기사, doi:10.1016/j.jconrel.2010.10.031
10. Malam Y, Lim E 및 Seifalian A(2011) Current trnds in application of nanoparticles in drug delivery(약물 전달에 나노 입자 적용에 관한 최신 추세), Current Medicinal Chemistry, 볼륨 18, 7번, 2011년 3월, 1067-1078페이지(12)
11. Ofek P, Fischer W, Calderon M, Haag R and Satchi-Fainaro R (2010) 생체 내 종양과 RNA간의 작은 인터페이스의 전달 및 dendritic nanocarrier에 의한 혈관 FASEB J..doi 10:1096/fj.09-14964
12. Ohlsson G, Tabaei S, Beech JP, Kvassman J, Johansson U, Kjellbom P , Tegenfeldt JO, Höök F(2012) Solute transport on the sub 100 ms scale across the lipid bilayer membrane of individual proteoliposomes(개별 프로테오리포좀의 지질 이중층 세포막 간 100ms 미만 이내 용질 이동), Lab Chip, 2012, Accepted Manuscript, DOI: 10.1039/C2LC40518K
13. Park J, Gao W, Whiston R, Strom T, Metcalfe S, Fahmy TM(2010) Modulation of CD4+ T Lymphocyte Lineage Outcomes with Targeted, Nanoparticle-Mediated Cytokine Delivery(표적 나노 입자 매개성 시토카인 전달을 통한 CD4+ T 림프구 조정), Mol. Pharmaceutics, 2011, 8(1), 143-152페이지
14. Ram M, Yaduvanshi KS, Yadav H, Singh N, Mangla G, Shivakumar H(2011) Nanoparticles, Promising Carriers in Drug Targeting: A review current drug therapy(나노 입자, 약물 표적의 유망한 전달체: 현행 약물 치료법 검토), 볼륨 6, 2번, 2011년 5월, 87-96페이지(10)
15. Reshetov 외, Photochem Photobiol. 2012년 9-10월,88(5):1256-64. doi: 10.1111/j.1751-1097.2012.01176.x
16. Shirali, 외 Am J Transplantation. 2011년 11월: 2582-2592
17. Sokolova V, Rotan O, Klesing J, Nalbant P, Buer J, Knuschke T, Westendorf AM, Epple M(2012) Calcium phosphate nanoparticles as versatile carrier for small and large molecules across cell membranes(세포막 사이의 대소 분자를 위한 다목적 전달체로서의 인산칼슘 나노 입자 ), Journal of Nanoparticle Research, 볼륨 14, 6번(2012), 910, DOI: 10.1007/s11051-012-0910-9
18. Soltan MK, Ghonaim HM, El Sadek M, Kull MA, El-aziz LA, Blagbrough IS(2009) Design and Synthesis of N4, N9-Disubstituted Spermines for Non-viral siRNA Delivery - Structure-Activity Relationship Studies of siFection Efficiency Versus Toxicity(비 바이러스 siRNA 전달을 위한 N4, N9-2기 치환 스페르민의 설계 및 합성 - siFection 효능과 독성 비교를 위한 구조-활동 관계 연구), Pharmaceutical Research, 볼륨 26, 2번, 286-295번
19. Sunshine 외 PLoS ONE, 2012, 7(5):e37543. doi:10.1371 /journal. Pone .0037543
20. Tagalakis A D, Grosse S M, Meng Q-H, Mustapa M F M, Kwok A, Salehi S E, Tabor A B, Hailes H C, Hart S L(2010) Integrin-targeted nanocomplexes for tumour specific delivery and therapy by systemic administration, Biomaterials(체계적 관리에 의한 치료 및 종양 전달을 위한 인테그린 표적 나노 복합체), 볼륨 32, 5호, 2011년 2월, 1370-6페이지
21. Tzeng 외 Biomaterials. 2011년 8월, 32(23): 5402-5410. doi:10.1016/j.biomaterials.2011년 4월.016
22. Wei A, Mehtala JG 및 Patri AK(2012) Challenges and opportunities in the advancement of nanomedicines(나노 의료의 발전에 관한 과제와 기회), Journal of Controlled Release, http://dx.doi.org /10.1016/j.jconrel.2012년 10월.007