이 응용 노트에서는 Zetasizer APS DLS(동적 광산란) 시스템의 정확성과 반복성을 확인하기 위해 교차 오염 테스트에 자주 사용되는 단백질 시료를 사용했습니다.
이 연구에서 사용한 단백질 시료는 보관 형태(인슐린 6합체)와 더 큰 응집체의 형태로 측정한 인슐린이었습니다. 인슐린 이외에도 다른 단백질로는 42 아미노산 긴 아밀로이드 베타 펩타이드(A베타)를 사용했습니다. A베타는 끈적거리는 성질이 있어 플라스틱에 잘 점착되므로 시료 시스템의 청결도 테스트에 적합합니다. A베타 시료는 미소 섬유와 올리고머의 두가지 형태가 있었습니다.
Zetasizer APS는 고품질 석영셀을 사용하여 온도 조정을 가능하도록 하여 사용자가 정확하고 반복성 높은 측정을 쉽게 할 수 있도록 설계되었습니다. 온도 제어의 정밀도와 측정 셀의 광학 품질에 따라 정확도는 달라집니다. 동일한 시료를 잘 혼합된 상태에서 채취하고 온도를 안정적으로 조절함으로써 재현성 있는 측정 결과를 얻을 수 있습니다.
96개 용기의 Corning Costar 플레이트를 사용하여 시료를 측정했지만, 플레이트의 길이와 높이가 표준 규격인 다른 플레이트도 사용할 수 있습니다. 각 용기의 시료를 측정 흐름 셀로 흡입했습니다. 측정을 시작하기 전 열 평형 상태를 만들기 위하여 20초간 안정화하였습니다. 각 시료를 3회 반복 측정하고 최적의 데이터 품질을 보장하기 위해 측정 시간은 소프트웨어에서 자동으로 설정하도록 하였습니다.
측정 후 시료를 버린 다음, 1250µl의 정제수를 주입한 후 3750µl 1M NaOH를 주입하여 시스템 내에 이물질이 남지 않도록 세척을 한 후, 잔류하는 NaOH를 제거하기 위하여 5000µl의 정제수로 다시 한번 세척하였습니다.
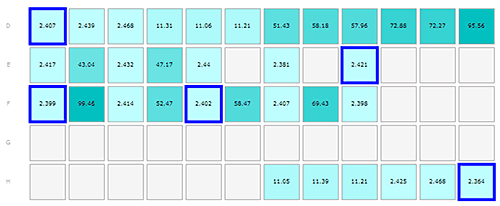
다음과 같은 방식으로 플레이트를 로드했습니다.
D1-3, E1, E3, E5, E7, E9, F1, F3, F5, F7, F9, H10-12 용기에 단량체 인슐린
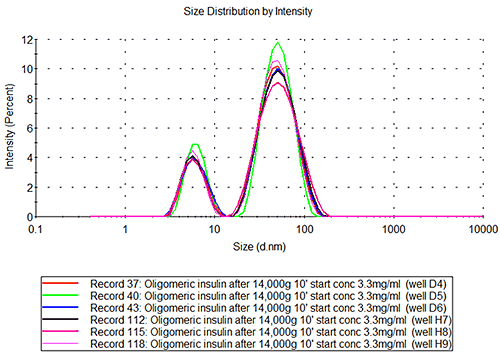
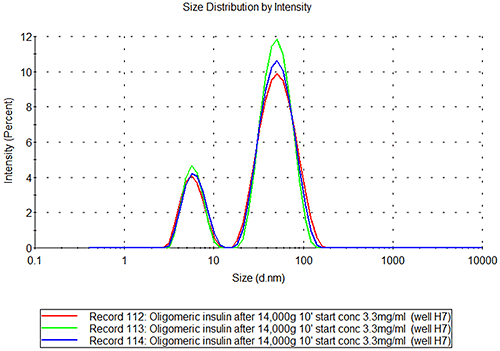
D4-6, H7-9 용기에 올리고머 인슐린
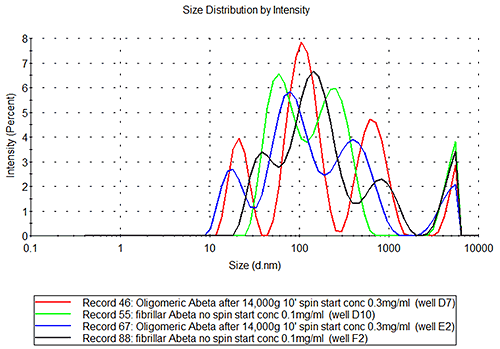
D7-9, E2, E4 용기에 올리고머 A베타 펩타이드
D10-12, F2, F4, F6, F8 용기의 미소 섬유 A베타
|
|
|
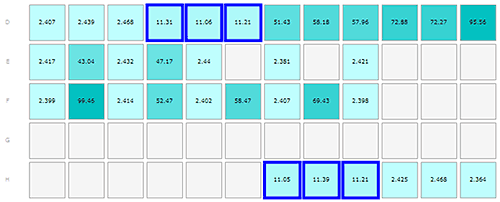
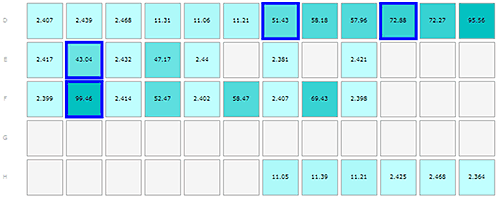
인슐린 및 A베타 시료의 결과가 그림 1-3에 나와 있으며, 플레이트 레이아웃은 각 그림에서 A 부분으로 표시되어 있어 플레이트에서 시료가 보관된 부분을 찾을 수 있습니다. 측정은 행의 경우 왼쪽에서 오른쪽 방향으로 진행하였으며 알파벳으로 각각의 행을 구분하였습니다.
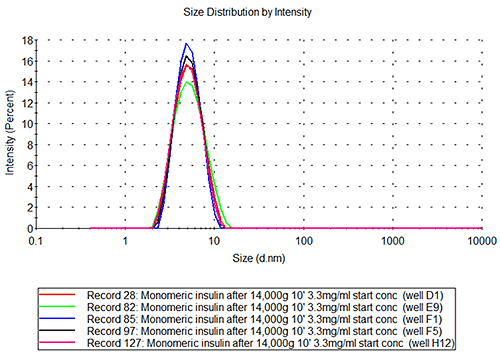
이러한 측정에서 얻은 단량체 인슐린의 평균(mean) 유체역학적 직경은 2.71+/-0.06nm으로, 이에 따른 예상 분자량은 34.7+/-1.8kDa입니다. 이 값은 6합체 인슐린의 알려진 분자량인 34.848kDa과 유사한 것을 알 수 있습니다.
|
|
|
인슐린 응집체 시료는 그림 2B와 같은 쌍봉 분포를 나타냅니다. 여기서 작은 피크는 인슐린 단량체의 피크와 동일한 크기입니다. 두 번째 피크는 반지름이 27+/-0.8nm이며 약 7.5MDa의 구형 단백질에 해당합니다. 응집체가 구형이 아닐 경우(예: 긴 구조) 측정된 크기는 훨씬 더 작은 분자량 구조에 해당합니다.
|
|
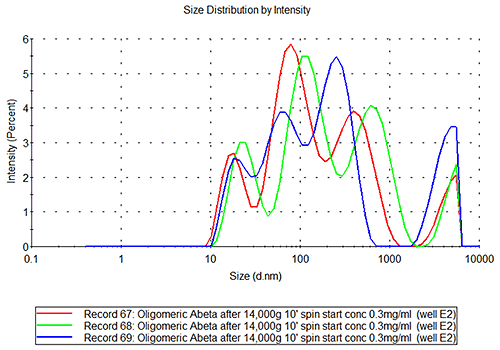
|
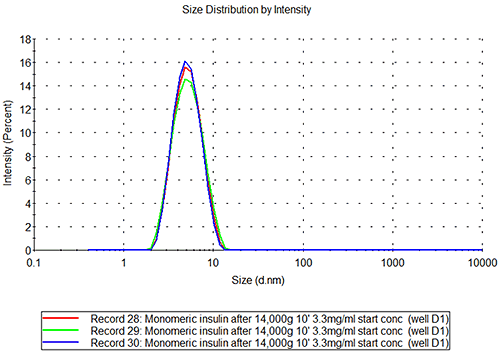
올리고머 및 미소 섬유 A베타 시료는 그림 3B에서 볼 수 있듯이 인슐린 시료와 같이 반복 또는 재현 가능하지 않습니다. 이러한 시료의 고유한 특성은 다릅니다. E2 용기의 시료의 측정 반복 가능성을 조사할 경우 그림 3C를 참조하십시오. 해당 시료는 분명히 다분산계에 속하며 상호 복제 편차가 관찰되는 시료로, 다른 종의 여러 개체군이 동시에 존재하고(단량체, 작은 올리고머, 단섬유, 소섬유 등) 각 개체군의 상대적 양은 시간에 따라 변경될 수 있습니다.
이러한 측정값은 Zetasizer APS가 DLS를 이용하여 안정적 단백질 시료를 위해 반복 가능하며 재현 가능한 크기 측정을 분명히 제공할 수 있다는 점을 나타냅니다.
인슐린 데이터는 웰 간의 편차가 낮다는 것은 알 수 있으며 이는 동일한 시료를 반복적으로 측정한 값의 오차가 작다는 것을 의미합니다. 분자 유체역학적 크기에서 얻은 값은 알려진 분자량에 기초하여 예상한 크기와 거의 일치합니다.