열 변성 및 응집체 형성 단백질 샘플 여러 개를 분석하여 동적 광산란(DLS)과 정적 광산란(SLS)이라는 두 가지 기술을 크기 배제 크로마토그래피(SEC-LS)와 결합했을 때 어떤 상호보완성이 있는지를 연구하였습니다. 여기서 열처리로 변형시킨 단백질과 응집을 유도한 단백질 샘플을 다양한 농도로 비변성 단백질 샘플과 혼합하였습니다.
주로 모노머, 다이머 및 트라이머가 균형을 이루며 존재하는 66kDa 소혈청알부민(BSA)을 이 연구에 사용하였습니다.
동결 건조 단백질을 pH 7.4의 인산염 완충액(PBS)에 용해시키고 0.02µm Whatman Anotop 10 필터로 여과하여 이미 형성돼 있는 응집체를 제거하였습니다. 샘플을 두 개의 로트로 분할하고 하나는 실온에, 다른 하나는 65°C에 12시간 보관하였습니다. BSA를 녹는점에 해당하는 65°C로 가열하면 샘플 일부에 열 변성이 일어나면서 응집체 형성이 유도됩니다.
열 변성 샘플과 비변성 샘플을 Viscotek GPC TDAmax로 분석하여 각각에 들어 있는 응집체를 정량화하였습니다. 이때 다이머보다 큰 BSA 올리고머를 응집체로 간주하였습니다.
열 변성 BSA 샘플의 경우 약 45%가 응집된 것으로 나타났습니다.
실온에 12시간 보관한 샘플은 광 산란 신호를 통해 응집체가 변화 추이를 파악할 수 있었지만 굴절률(RI) 신호를 감지하기에는 그 양이 너무 적었습니다. 따라서 해당 시료의 정량 분석은 불가능했습니다.
열 변성 BSA 샘플을 각기 다른 양으로 비응집 샘플에 주입한 다음 이 혼합물에 대해 먼저 DLS를 분석 원리로 이용하는 Zetasizer Nano-S와 Viscotek TDAmax를 이용한 SEC-LS로 측정하여 각각의 분석법으로 산출된 결과를 직접 비교하였습니다.
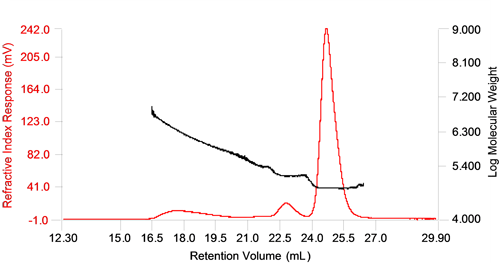
그림 1은 열 변성 및 응집 BSA 샘플 11.5%가 포함된 샘플의 크로마토그램을 보여 줍니다. 굴절률(RI) 변화와 분자량 변화 데이터가 나와 있습니다. 분자량은 RI를 정적 광 산란 신호(LS)와 조합하여 측정했습니다.
|
모노머 피크와 다이머 피크는 명확하게 구분되며 각각에 대해 측정된 분자량이 변하지 않아 다분산성이 낮다는 것을 알 수 있습니다. 그러나 거대 올리고머와 응집체의 피크는 명확하게 구분되지 않았으며 피크 간 분자량 분포가 커서 다분산성이 높은 것으로 나타났습니다. 응집체는 일반적으로 균일한 군체를 형성하지 않고 응집체 형성에 사용되는 단백질의 양에 따라 크기가 다양하기 때문에 단백질 응집체가 높은 분산성을 나타내는 것은 흔한 경우입니다.
다양한 샘플에서 나온 결과가 표 1에 제시되어 있습니다. 투입된 응집체의 양은 샘플 내 단백질의 총 몰 수 대비 응집 BSA의 몰 %로 표시되어 있습니다. 2번째 열에는 SEC-LS로 분석한 응집체의 분자량 분율이 표시되어 있습니다. 응집체 함량이 적은 샘플의 정량 분석 결과는 기대치 범위 내에 있기는 하지만 상대적으로 정밀도가 낮습니다. 측정 정확도를 낮추는 요인은 이러한 낮은 농도에서의 RI 신호입니다.
SEC-LS | DLS | |||||
|---|---|---|---|---|---|---|
| 응집체 투입량(%) | 측정된
응집체 량 | Int% pk1 | Int% pk2 | Vol% pk1 | Vol% pk2 | %Pd |
| 0 (측정 전에 20nm 포어
크기로 여과) | - | 100 | 0 | 100 | 0 | 21.4 |
| 0 (25°C에 12시간 보관한 샘플) | 0 | 99.1 | 0.9 | 100 | 0 | 33.2 |
| 0.225 | 0.4 | 97.1 | 2.9 | 100 | 0 | 36.1 |
| 0.45 | 0.6 | 94.4 | 5.6 | 100 | 0 | 41.2 |
| 1.125 | 1 | 87.5 | 12.5 | 100 | 0 | 48.0 |
| 2.25 | 2.1 | 75.9 | 24.1 | 99.8 | 0.2 | 53.8 |
| 4.5 | 4.4 | 53.5 | 46.5 | 99.4 | 0.6 | 59.2 |
| 11.25 | 10.6 | 30 | 70 | 96.7 | 3.3 | 57.4 |
| 22.5 | 21.8 | 17.9 | 82.1 | 90.2 | 9.8 | 51.0 |
| 45 | 44.5 | 0 | 100 | 0 | 100 | 42.4 |
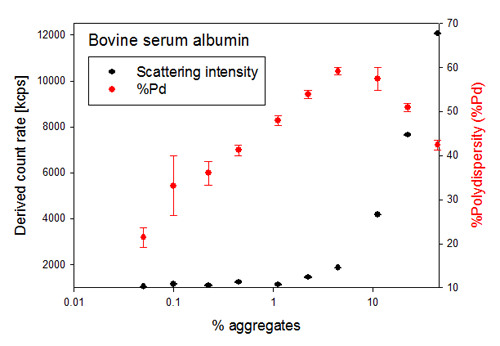
샘플에 의해 산란된 빛의 양은 입자 직경의 6승과 함유된 분자의 양(샘플 농도)에 비례하기 때문에 DLS로 검출한 샘플에서 응집체 형성의 첫 번째 징후는 일반적으로 샘플에 의한 광 산란의 총 강도가 달라지는 것입니다. 그림 2에서 이러한 데이터와 함께 각 샘플의 %다분산성(%Pd)을 확인할 수 있습니다. %Pd 값은 다분산성 지수(PdI) [(100*(PdI)½]를 이용해 계산할 수 있으며 그 범위는 0%에서 100% 사이입니다. 일반적으로 단분산성이 높은 샘플은 %Pd 값이 20% 미만입니다.
|
그림 2와 같이 소량의 응집체가 비응집 샘플에 추가되면서 %Pd가 급격하게 변합니다. %Pd는 상대 값으로 샘플 내 응집체의 양이 많아지면서 함께 증가하지만 응집체가 일정량에 도달하면 오히려 %Pd가 감소하기 시작합니다. 이러한 변화 양상이 나타나는 것은 %Pd가 샘플의 다분산성, 즉 한 샘플 내에서 각기 다른 크기의 군체가 동시에 얼마나 많이 검출되는가에 따라 달라지며 샘플의 응집체 형성 상태와는 무관하기 때문입니다.
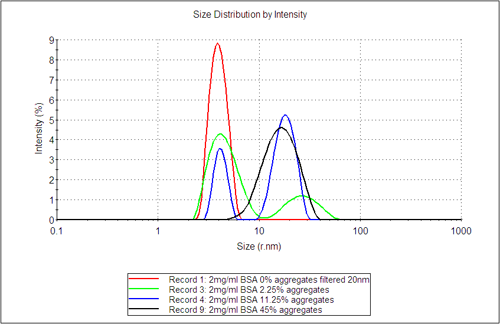
그림 3에는 DLS 분포 분석 결과가 나와 있으며, 투입된 응집체의 함량 증가에 따른 이차 응집 군체의 출현 양상에 초점이 맞추어져 있습니다. 산란 강도에 기초한 분포 분석에서 각기 다른 군체에 의해 산란되는 광량의 분율을 알 수 있습니다. 한편, Mie 이론을 이용하여 추정한 부피 분율을 통해서는 각기 다른 군체에 대해 부피(질량)를 기준으로 한 상대 분율을 알 수 있습니다. 이 값은 표 1에 나와 있습니다. 세 번째와 네 번째를 보면 응집체에 의해 산란되는 빛의 양을 바탕으로 DLS 기술이 얼마나 정확하게 미량 응집체를 검출해 내는지를 명확하게 알 수 있습니다. 이 예에서는 이러한 사실이 측정 직전에 20nm 필터로 여과한 샘플을 25°C에 12시간 보관한 샘플과 비교하는 방식으로 강조되어 있습니다.
|
부피 분율 비교에서는 응집체 함량이 2.25%를 초과하는 샘플에서만 유의한 수준의 응집체 성분을 검출합니다. DLS를 통해 분석한 샘플의 상대 부피 분율 추정치를 SEC-LS로 분석한 중량 분율과 비교해 보면 DLS가 비정량적 분석법임에도 불구하고 샘플 내 응집체 형성 상황을 쉽고 빠르게 알려 주는 수단이라는 것을 분명하게 알 수 있습니다.
SEC-LS와 DLS를 이용한 응집체 검출 결과 데이터를 비교해 보면(표 1) 이 두 가지 기술이 서로 다르지만 상호보완적인 정보를 제공해 준다는 것을 분명하게 알 수 있습니다. SEC-LS로는 샘플 내에 존재하는 응집체의 양을 1% 미만 수준까지 정량화할 수 있으며 개별 샘플 피크의 다분산성을 확인하고 각기 다른 피크에서 용리되는 함유 분자의 분자량을 알 수 있습니다. SEC-LS의 정량 정확도는 RI 검출기와 LS 검출기의 상대적인 감도에 의해 좌우됩니다. 즉, 응집체 농도가 매우 낮은 샘플에서는 LS 검출기로 존재 여부를 알 수 있는 응집 물질을 RI 검출기로 정량 분석할 수 없습니다.
대형 물질이 소량으로 들어 있는 샘플에 대한 감도와 짧은 측정 시간으로 인해 DLS는 제형 개발 연구에 자주 활용됩니다. 즉, 물질 분해 유도 연구에서 응집체 형성이 시작되는 초기 단계를 감지해 내는 역할을 하는 것입니다. DLS는 컬럼 특이적 용리 완충액 없이 제형 완충액으로 직접 측정할 수 있어 샘플 상태가 완충액으로 인해 달라질 위험을 최소화할 수 있다는 장점이 있습니다.
SEC-LS와 DLS는 상호보완적인 기술입니다. DLS는 다양한 제형의 완충액에서 응집체 형성을 조기에 감지할 수 있다는 장점 때문에 광범위한 유형의 샘플 스크리닝에 이용할 수 있습니다. SEC-LS는 정량 분석 기술로서 SEC에 기반한 높은 샘플 분해능으로 응집체와 올리고머형 군체의 함량을 파악할 수 있을 뿐만 아니라 연구 대상 제제에 들어 있는 개별 물질의 분자량까지 알 수 있습니다.