리포솜은 수용액 용적을 둘러 싸고 있는 두 층의 지질 분자로 구성된 액포입니다[1].
이것은 원래 삼투성같은 막 특성을 연구하기 위한 모델 조직으로 사용되었습니다[2]. 최근에는 수용액 용적의 수용성 물질이나 지질 두 층의 지용성 물질을 통합할 수 있는 능력 때문에 약물 전달 수단에 주로 사용되고 있습니다 [3-5]. 항체나 펩티드를 결합시켜 지질 조성을 조절하거나 표면을 수정하여 특정 응용 부문에 맞게 리포솜을 설계할 수 있습니다[6-8]. 예를 들어 , 양이온 리포솜은 DNA 복합체 형성 능력 때문에 유전자 요법에서 사용됩니다[9,10].
정맥으로 주사된 리포솜의 거동은 여러 가지 특성으로 결정됩니다. 가장 중요한 특성 두 가지는 입도와 제타 전위입니다. 리보솜 작용 사이트 - 신체의 세포 상호 작용은 대부분의 크기에 의해 결정된다. 작은 리보솜은 간 안의 작은 공간을 통과할 수 있다. 중간 크기 리보솜은 혈액 내에 유지되어 장시간 순환할 수 있다. 큰 리보솜은 빠르게 쿠퍼 세포에 의해 제거된다. 이 두 매개변수 모두 Zetasizer Nano 기기에서 측정할 수 있습니다. 입도는 동적 광산란법 (DLS)으로 측정합니다 . 이 방법은 불규칙적인 브라운 운동 (Brownian motion)을 실시하여 입자 현탁액에서 산란광 세기의 시간 의존적 변동을 측정하는 것입니다. 이러한 세기 변동을 분석하면 입도 분포로 변환되는 확산 계수를 결정할 수 있습니다.
입자의 제타 전위는 입자가 특정 매체에서 얻는 전체 전하입니다. 리포솜 시료의 제타 전위를 알면 생체 안 리포솜의 거동을 예측하는데 도움이 됩니다 . 유전자 치료에 있어서, 제타 전위는 응집을 최소화를 위해 DNA 플라스미드에 리포솜의 비율을 최적화하기 위해 사용될 수있다. Zetasizer Nano 에서 시료의 제타 전위 측정은 레이저 도플러 전기영동법을 이용하여 실시합니다. 이러한 방법에 관한 자세한 내용은 Malvern Instruments 웹사이트의 Technical notes 와 기타 응용 부문에서 확인할 수 있습니다 .
본 Application note 에는 음이온 및 양이온 리포솜에 실시한 입도 및 제타 전위 측정이 요약되어 있습니다 .
리포솜은 초음파 분해법으로 준비했습니다[1]. 음이온 리포솜은 표 1 과 같이 Phosphate buffered saline(PBS)에 DPPC (Dipalmitoyl phosphatidylcholine) 과 DPPG(Dipalmitoylphosphatidyl glycerol) 을 다양하게 혼합하여 준비 했습니다. 양이온 리포솜은 표 2 와 같이 DPPC, 콜레스테롤, 양이온 계면 활성제 DDAB(Dioctadecylammonium bromide) 로 준비했습니다 . 모든 경우 에서 리포솜의 최종 농도는 4mg lipid / ml PBS 이었습니다.
| DPPC (mg) | DPPG (mg) | DPPG (mole %) | PBS (ml) |
|---|---|---|---|
| 19 | 1 | 5.2 | 5 |
| 18 | 2 | 10.9 | 5 |
| 17 | 3 | 17.4 | 5 |
| 16 | 4 | 24.6 | 5 |
| 15 | 5 | 32.8 | 5 |
| DPPC (mg) | Cholesterol (mg) | DDAB (mg) | DDAB (mole %) | PBS (ml) |
|---|---|---|---|---|
| 17 | 2 | 1 | 5.6 | 5 |
| 16 | 2 | 2 | 11.8 | 5 |
| 15 | 2 | 3 | 18.6 | 5 |
| 14 | 2 | 4 | 26.1 | 5 |
| 13 | 2 | 5 | 34.6 | 5 |
지질은 얇은 지질막을 얻기 위해 클로로포름(DPPG 는 클로로포름 / 메탄올 혼합물 (2:1 v/v)로 용해)과 60°C 에서 회전 증발로 제거한 용제에 용해시켜 혼합했습니다 . 적정량의 PBS(60°C 로 예열)를 첨가한 후 회전 혼합기에서 용기를 세게 흔들어 multilamellar vesicles(MLV) 를 만들었습니다. 그런 다음 MLV 를 60°C 에서 15 분간 초음파 분해하여 단일 lamellar 리포솜을 만들었습니다 . 초음파 분해 후 리포솜 시료를 60°C 에서 15 분간 배양하여 서서히 식혔습니다 [1].
Zetasizer Nano ZS 를 이용하여 25°C 에서 크기 및 제타 전위를 측정했습니다. 크기 측정은 순 리포솜 시료에서 실시했으며 제타 전위 측정을 위한 시료는 PBS 로 1/10 희석했습니다. Nano ZS 에는 크기 측정을 위한 비침투성 후방 산란(NIBS™) 광학이 포함되어 있습니다. 농축되어 탁한 시료의 크기 측정은 173°의 검출 각도에서 가능합니다. 단, 제타 전위 측정 시 시료에서 검출된 산란광은 12°의 전방 각도에서 측정 가능합니다. 따라서 레이저가 시료를 지나가야 하며 , 그 결과 제타 전위 측정을 위한 시료의 농도가 크기 측정용보다 낮아야 합니다.
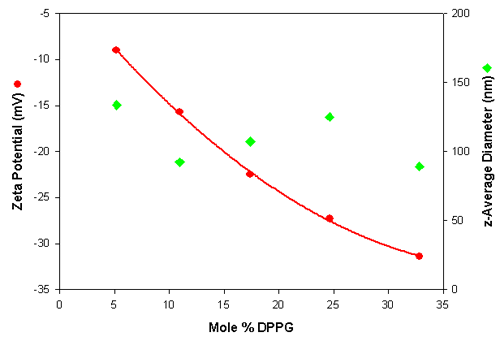
다양한 음이온 리포솜의 입자 크기 결정 및 제타 전위 측정 결과가 표 3 에 요약되어 있습니다. 이 표에는 z-평균 직경(산란광 세기에 따른 평균 직경 ), 다분산 지수 (분포 폭 추정값 ) 및 다양한 리포솜 시료로 구한 평균 제타 전위 값이 나옵니다 . z-평균 직경 값은 순 리포솜 시료에 실시한 3 회 반복 측정(괄호 안은 표준 편차 )의 평균입니다. 제타 전위 값은 희석한 시료(PBS 로 1/10)에 실시한 5 회 반복 측정의 평균입니다 .
| Mole % DPPG | z-Average Diameter in nm (SD) | Polydispersity (SD) | Zeta Potential in mV (SD) |
|---|---|---|---|
| 5.2 | 133.8 – 0.4 | 0.292 – 0.03 | 9.0 – 0.64 |
| 10.9 | 92.3 – 0.49 | 0.269 – 0.01 | 15.7 – 1.36 |
| 17.4 | 107.2 – 0.20 | 0.256 – 0.01 | 22.5 – 0.95 |
| 24.6 | 125.1 – 0.60 | 0.261 – 0.01 | 27.3 – 1.29 |
| 32.8 | 89.2 – 1.39 | 0.264 – 0.01 | 31.4 – 0.98 |
이러한 음이온 리포솜 시료로 구한 크기 결정 값을 보면 시료의 수조 초음파 분해를 통해서도 크기 평균과 분포 폭이 같음을 알 수 있습니다.
그림 1 에 제타 전위와 크기 값이 DPPG 몰%에 따라 표시되어 있습니다. 데이터를 보면 각 리포솜 시료의 측정 반복성이 매우 높다는 것과 DPPG 함유량이 증가할수록 음전하를 띠는 경향을 보인다는 것을 알 수 있습니다. In addition, the results show that the size is independent of the liposome composition.그리고 이러한 결과를 통해 입도는 리포솜 조성과는 무관하다는 것도 알 수 있습니다.
|
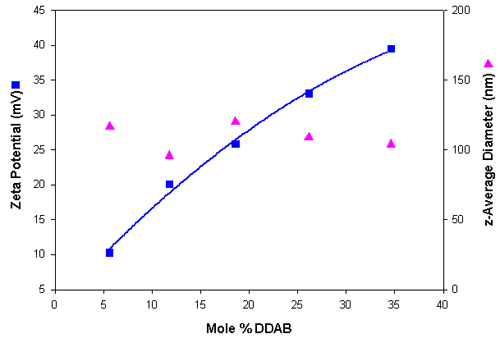
표 4 에는 양이온 리포솜으로 구한 입도 및 제타 전위 결과가 요약되어 있습니다. 음이온 리포솜 시료에 비해 크기 분포가 비슷하게 나왔습니다. 그림 2 는 DDAB 몰%에 따른 제타 전위와 입도 결과를 보여주는 것으로 , 리포솜의 DDAB 함유량이 증가함에 따라 점차 양전하를 띠는 경우가 많음을 알 수 있습니다.
|
| Mole % DDAB | z-Average Diameter in nm (SD) | Polydispersity (SD) | Zeta Potential in mV (SD) |
|---|---|---|---|
| 5.6 | 116.6 – 1.0 | 0.258 – 0.01 | 10.3 – 0.88 |
| 11.8 | 95.8 – 0.36 | 0.223 – 0.01 | 20.1:1.36 |
| 18.6 | >120.3:0.40 | 0.266 – 0.01 | 25.9 – 0.52 |
| 26.1 | 109.0 – 1.15 | 0.270 – 0.01 | 33.1:2.2 |
| 34.6 | 104.0 – 0.42 | 0.251 – 0.01 | 39.5 – 1.2 |
리포솜의 물리적 특성 규명은 다양한 응용 부문에서 그것이 적합한지 여부를 파악할 때 매우 중요합니다. 리포솜 시료의 제타 전위를 알면 생체 안에서 리포솜의 거동을 예측하는데 도움이 됩니다. 하전 리포솜을 반대 전하의 분자와 결합시킨 것을 그 복합체의 제타 전위를 측정하여 모니터링할 수 있습니다.
Zetasizer Nano 시리즈를 사용하여 본 Application note 에서 자세히 설명한 것처럼 리포솜의 입도와 제타 전위 모두의 특성을 신속하고 반복적으로 규명할 수 있습니다.
[1] New, R.R.C. (1992) in Liposomes: A Practical Approach, IRL Press, Oxford, UK.
[2] Bangham, A.D., Hill, A.W. and Miller, N.G.A. (1974) in Methods in Membrane Biology, vol. 1, pp 1-68, Plenum Press, New York.
[3] Schmidt, K.H. (ed.) (1986) in Liposomes as Drug Carriers, Verlag, Stuttgart and New York.
[4] Knight, G. (ed.) (1981) in Liposomes: From Physical Structure to Therapeutic Applications, Elsevier/North Holland Biomedical Press, Amsterdam.
[5] Gregoriadis, G. (1988) in Liposomes as Drug Carriers: Recent Trends and Progress, John Wiley and Sons, Chichester, UK.
[6] Hutchinson, F.J., Francis, S.E., Lyle, I.G. and Jones, M.N. (1989) Biochim. Biophys. Acta 978: 17-24
[7] Jones, M.N. and Kaszuba, M. (1994) Biochim. Biophys. Acta 1193: 48-54
[8] Kaszuba, M., Lyle, I.G. and Jones, M.N. (1995) Colloids and Surfaces 4, 151-158.
[9] Pedroso De Lima, M.C., Simoes, S., Pires, S. Faneca, H. and Duzgunes, N. (2001) Adv. Drug Deliv. Rev. 47, 277-294.
[10] Eastman, S.J., Siegel, C., Tousignant, J., Smith, A.E., Cheng, S.H. and Scheule, R.K. (1997) Biochim. Biophys. Acta 1325: 41-62