In Kombination können Lichtstreuung und Mikrokapillarviskometrie dazu verwendet werden, ein Stabilitätsprofil zur Untersuchung von in Frage kommenden Biotherapeutika zu entwickeln, wobei die Lichtstreuung eine Reihe von Verdünnungslösungseigenschaften und die Mikrokapillarviskometrie eine Analyse der Viskosität selbst bei einer hohen Probenkonzentration liefert. Die Fähigkeit, sowohl geringe Probenmengen als auch hohe Probenkonzentrationen verarbeiten zu können, macht diese beiden Technologien ideal dazu, den Untersuchungsprozess für Biotherapeutika in Hinsicht auf Vorhersage und Bestätigung in eine frühere Phase der Entwicklung zu verlagern.
Hier beschreiben wir die Entwicklung eines Stabilitätsprofils biologischer Rezepturen, das aus Lichtstreuungsanalyse im Submikrometerbereich und Mikrokapillarviskometrie abgeleitet wird.
Lichtstreuung ist innerhalb der biopharmazeutischen Industrie eine Grundtechnologie, die routinemäßig dazu verwendet wird, in Frage kommende Biotherapeutika und Formulierungen zu untersuchen. Historisch betrachtet haben Lichtstreuungstechnologien im Submikrometerbereich (z.B. statische (SLS), dynamische (DLS) und elektrophoretische (ELS) Lichtstreuung) innerhalb der Rezepturentwicklung bisher in erster Linie eine Überwachungsrolle gespielt. Klassische Beispiele dafür sind die Verwendung von DLS zum Prüfen auf das Auftreten von Aggregaten bei Belastungstests oder die Verwendung von ELS zum Überwachen von Änderungen im Zetapotenzial der Probe und ihrer nachfolgenden kolloidalen Stabilität bei Umgebungsänderungen wie z.B. Änderungen des pH-Werts und der Ionenstärke. Das Zetasizer Nano-System von Malvern Instruments kombiniert alle drei Lichtstreuungstechnologien und ist in der Lage, Informationen zur Partikelgrößenverteilung, zum Polydispersitätstrend und zum Wechselwirkungsparameter aus DLS, dem zweiten Virialkoeffizienten aus SLS und der elektrophoretischen Mobilität und effektiven Ladung aus ELS zu liefern. Jede dieser unter Verdünnungsbedingungen gemessenen Eigenschaften erwies sich empirisch als vorhersagefähiger Indikator für Aggregationsneigung, Löslichkeit und erhöhte Viskosität unter den Bedingungen hoher Konzentration, die für Rezepturen von Biotherapeutika typisch sind.
Während vorhersagefähige Parameter nützlich zum Ausfiltern in Frage kommender Produkte sind, die sich wahrscheinlich als problematisch erweisen werden, müssen in Frage kommende Produkte, die diese Untersuchung bestehen, letztendlich auf Stabilität und Viskosität unter der Bedingungen hoher Konzentration getestet werden, die für die endgültigen biologischen Rezepturen zu erwarten sind. Bisher wurden Viskositätstests aufgrund von Probenvolumenbeschränkungen auf die späteren Phasen der Formulierungsentwicklung verschoben. Die Mikrokapillarviskometrie bietet die Möglichkeit, diese Hürde zu überwinden. Diese im Viscosizer 200 von Malvern Instruments integrierte Technologie kombiniert UV Absorption mit einer Mikrokapillarerkennung in zwei Durchläufen, um die Viskositäten von Biotherapeutika-Formulierungen hoher Konzentration unter Verwendung eines Probenvolumens von nur 10 µL zu messen.
Durch Koppeln der durch die Lichtstreuung erhaltenen Parameter mit den aus der Mikrokapillarviskometrie erhaltenen Parametern kann ein umfassendes Stabilitätsprofil biologischer Formulierungen für in Frage kommende Proteintherapeutika abgeleitet werden, das in frühen Phasen der Formulierungs-Entwicklung verwendet werden kann. Zusätzlich zu den offensichtlichen Zeit- und Ressourceneinsparungen, die mit dem Reduzieren der Größe des Pools in Frage kommender Rezepturen in einer früheren Phase der Entwicklung einhergehen, bietet das Stabilitätsprofil dem Entwickler das Potenzial, die Produktleistung zu verbessern und gleichzeitig Einblicke in die mit der Substanzinstabilität verbundenen Mechanismen zu gewinnen.
Analytische Instrumente können sowohl zum Überwachen als auch zum Vorhersagen von Probeneigenschaften verwendet werden. Ein Beispiel für eine Überwachung mithilfe statischer Lichtstreuung wäre die Bestimmung des Molekulargewichts und des Konjugationsgrads zu dem Zweck, die Zahl der Glykosilierungsstellen auf einem mAk (monoklonalen Antikörper) zu ermitteln. Lichtstreuungsverfahren werden routinemäßig dazu verwendet, während Belastungstests biologischer Formulierungen eine Vielzahl von Eigenschaften zu überwachen, um sie auf das Vorhandensein von Aggregaten oder Partikeln im Submikrometerbereich zu überprüfen. Alternativ kann eine unter einer bestimmten Gruppe von Bedingungen gemessene Rezeptureigenschaft dazu verwendet werden, das Verhalten der Rezeptur unter einer anderen Gruppe von Bedingungen vorherzusagen. Ein Beispiel für diese Möglichkeit ist die Untersuchung in Frage kommender Biotherapeutika auf ihre Aggregationsneigung bei (für Formulierungen typischen) hohen Konzentrationen auf der Grundlage von unter Verdünnungslösungsbedingungen gemessenen Werten des zweiten Virialkoeffizienten. Zusätzlich zum zweiten Virialkoeffizienten werden noch weitere Lichtstreuungseigenschaften wie z.B. Größenverteilung und Polydispersitätstrends, der DLS-Wechselwirkungsparameter sowie die effektive Proteinladung in Screening-Assays integriert.
Die dynamische Lichtstreuung (DLS) ist ein Verfahren mit niedriger Auflösung, das eine dreifache Größendifferenz erfordert, um in der Partikelgrößenverteilung (PSD) eine Basislinienauflösung zu erzielen. Die Streuintensität variiert jedoch mit der 6. Potenz des hydrodynamischen Radius. Obwohl DLS nicht in der Lage ist, Proteinoligomere aufzulösen, kann ihre hohe Empfindlichkeit für größere Partikel dafür genutzt werden, subtile Änderungen in der Verteilung von Proteinoligomeren zu überwachen. Betrachten Sie zum Beispiel die in Abbildung 1 für in zwei Puffern verdünntes Immunglobulin G (IgG) gezeigten DLS-Größenverteilungen, wobei RS für den an der Grenze unendlicher Verdünnung gemessenen hydrodynamischen Radius steht. Wenn die Konzentration erhöht wird, zeigt Puffer 1 (links) eine Zunahme der Verteilungsbreite, was vermuten lässt, dass mit zunehmender Probenkonzentration oligomere Spezies gebildet werden. Diese Ergebnisse weisen auf reversible Selbstassoziation hin. Bei Puffer 2 (rechts) dagegen führt eine Erhöhung der Probenkonzentration offenbar zu einer Abnahme der Größenverteilung ohne signifikante Änderung der Verteilungsbreite. Diese Ergebnisse weisen auf eine elektrostatische Abstoßung hin, da die augenscheinliche Abnahme der Größe eher elektrostatischen Kräften als einer Zunahme des Diffusionskoeffizienten zuzuschreiben sind.
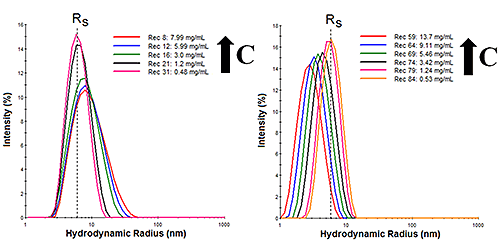
|
Die mechanistische Interpretation der Ergebnisse in Abbildung 1 ( z.B. reversible Selbstassoziation kontra elektrostatische Abstoßung) ist ein wenig leichter zu veranschaulichen, wenn die Ergebnisse in dem in Abbildung 2 gezeigten Grafikformat präsentiert werden. Die DLS-Polydispersität (Pd) ist die Breite oder die Standardabweichung der Größenverteilung und wird in den unten gezeigten Konzentrationstrends durch Fehlerleisten repräsentiert. Wie in dieser Abbildung zu erkennen ist, nehmen mit steigender Konzentration in Puffer 1 sowohl die Größe als auch die Breite der oligomeren IgG-Verteilung ab, was auf reversible Selbstassoziation hinweist. Bei Puffer 2 dagegen ist die Breite der Verteilung von der Probenkonzentration unabhängig, d.h. sie bleibt konstant, aber die mittlere Größe ist bei höheren Konzentrationen kleiner als RS. Da RS als die physikalische Größe des Antikörpers in Abwesenheit von eingeschränkter Diffusion (Viskosität) oder Partikel-Wechselwirkungseffekten definiert ist, besteht die einzige Erklärung dafür, dass ein Protein kleiner erscheint, als es tatsächlich ist, darin, dass die Partikel sich mit einer Geschwindigkeit bewegen, die höher als die Diffusionsgeschwindigkeit ist. In Abwesenheit einer Temperaturerhöhung ist die elektrostatische Abstoßung die einzige Kraft, die verfügbar ist, um die Diffusionsgeschwindigkeit zu erhöhen.
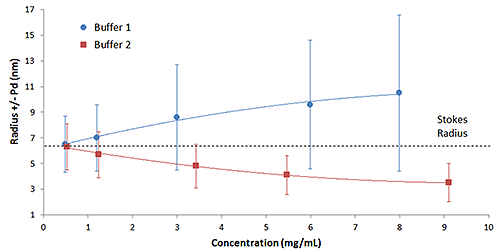
|
Die im Größenverteilungs- und Pd-Trend enthaltene qualitative Information kann mit dem DLS-Wechselwirkungsparameter (kD) quantitativ ausgedrückt werden. kD wird aus der Steigung der Konzentrationsabhängigkeit des gegenseitigen Diffusionskoeffizienten (D) extrahiert, wie aus dem unten gezeigten Ausdruck ersichtlich ist, in dem D0 den Selbstdiffusionskoeffizienten an der Grenze von Konzentration Null (C) repräsentiert, aus dem der hydrodynamische Radius abgeleitet wird, und B22 für den zweiten Virialkoeffizienten, MW für das Molekulargewicht, kf für den Konzentrationskoeffizienten erstenGrades des Reibungskoeffizienten und υ für das partielle spezifische Volumen steht.
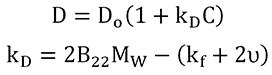
|
Empirisch hat sich gezeigt, dass kD sowohl mit der Aggregationsrate als auch mit der Rezepturviskosität in Beziehung steht. Proben mit größeren positiven kD-Werten zeigen eine geringere Neigung zu Selbstassoziation und Aggregation sowie niedrigere Viskositäten bei den für Biotherapeutikarezepturen typischen hohen Konzentrationen. Aufgrund dieser empirischen Vorhersagen wäre zu erwarten, dass Puffer 1 aus dem vorherigen Beispiel, in dem reversible Selbstassoziation zu sehen war, einen kleineren kD-Wert als Puffer 2 hat, bei dem eine stabilisierende elektrostatische Abstoßung zu erkennen war. Abbildung 3, die die Konzentrationsabhängigkeit des Diffusionskoeffizienten für IgG in den Puffern 1 und 2 zeigt, bestätigt diese Erwartung.
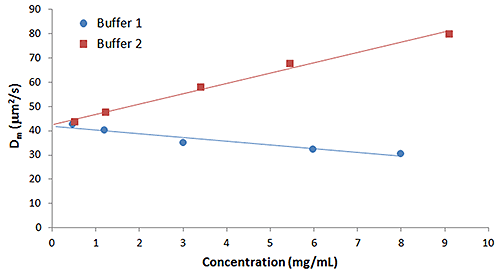
|
kD besitzt 2 Komponenten: eine thermodynamische Komponente (B22MW) und eine hydrodynamische Komponente (kf + υ). Die Vorhersagekraft von kD ist eine Folge der thermodynamischen Komponente, insbesondere der Komponente B22. Der zweite Virialkoeffizient (B22) ist repräsentativ für das Potenzial zu paarweiser Wechselwirkung zwischen gleichen Molekülen. Positive B22-Werte weisen auf stark solvatisierte Proben hin. Negative B22-Werte dagegen weisen auf Proben mit einer Neigung zu Selbstassoziation und geringer Löslichkeit hin.
B22 wird aus der Steigung eines Debye-Plots extrahiert, der für die Konzentrationsabhängigkeit der Streuintensität der Probe repräsentativ ist, wie aus dem unten gezeigten Ausdruck ersichtlich ist, in dem K eine optische Konstante repräsentiert, R
θ
für das Rayleigh-Verhältnis zwischen der Intensität von gestreutem Licht und einfallendem Licht, MW für den gewichteten Durchschnitt des Molekulargewichts und P(θ) für den Formfaktor steht, der bei kleinen Proteinen wie z.B. Antikörpern gleich 1 ist.
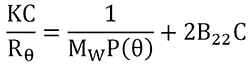
|
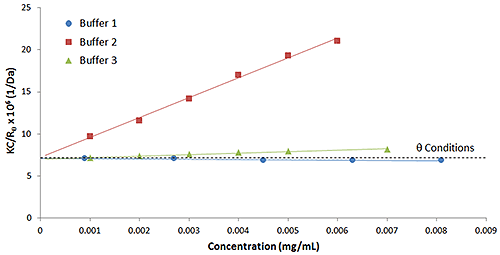
Abbildung 4 zeigt einen Vergleich der Debye-Plots für das vorherige Beispiel für IgG in Puffer 1 und 2 mit einem 3. Puffer, der einen Laktose-Stabilisator verwendet. Wie in dieser Abbildung zu sehen ist, weisen Puffer 2 und 3 positive Virialkoeffizientwerte und Puffer 1 einen negativen Virialkoeffizientwert auf. Daher wäre auf der Grundlage empirischer Vorhersagen zu erwarten, dass Puffer 2 am stabilsten und Puffer 1 am instabilsten ist und Puffer 3 irgendwo dazwischen liegt.
Puffer 3 hebt die Bedeutung der hydrodynamischen Komponente in kD hervor. Obwohl dies in Abbildung 3 nicht gezeigt wird, wies IgG in Puffer 3 einen kD-Wert auf, der negativer als bei den Puffern 1 und 2 war, denn bei den Puffern 2, 1 und 3 wurden (in der entsprechenden Reihenfolge) die kD-Werte 31,9 mL/g, -5,2 mL/g und -9,7 mL/g gemessen. Wenn man die hydrodynamische Komponente ignorieren würde, könnte man fälschlicherweise die Schlussfolgerung ziehen, dass Puffer 1 wahrscheinlich stabiler als Puffer 3 sein wird. Die B22-Ergebnisse zeigen jedoch, dass dies nicht der Fall ist. Aus diesem Grund wird die Verwendung von kD als Stabilitätsindikator, obwohl es leichter zu messen ist als B22, generell auf den Bereich kD > 0 beschränkt und B22 im breitesten Bereich von Rezepturbedingungen als zuverlässigerer Indikator betrachtet.
|
Der Begriff „intrinsisch“ wird hier zum Identifizieren von Eigenschaften des Proteins innerhalb des Rezepturpuffers, aber in Abwesenheit konzentrationsabhängiger Effekte verwendet, die sich auf die ermittelten Werte auswirken. Zu den konzentrationsabhängigen Effekten zählen eingeschränkte Diffusion und/oder elektrostatische Wechselwirkungen, und durch das Bestimmen intrinsischer Eigenschaften an der Grenze unendlicher Verdünnung können diese Effekte minimiert werden.
Der gewichtete Durchschnitt des Molekulargewichts (MW) wird im Verlauf einer Ensemble-SLS-Messung des zweiten Virialkoeffizienten abgeleitet. Aufgrund der Massengewichtung können kleine Mengen oligomerer Spezies eine starke Auswirkung auf MW haben. Falls das monomere Molekulargewicht bekannt ist, wie es oft der Fall ist, dann kann ein Vergleich mit dem oligomeren MW eine qualitative Vorstellung von dem Grad der Oligomerisierung liefern.
Der hydrodynamische Radius (RS) wird im Verlauf einer Ensemble-DLS-Messung des Wechselwirkungsparameters (kD) abgeleitet. Der hydrodynamische Radius ist eine intensitätsgewichtete durchschnittliche Größe der oligomeren Verteilung. Der Vergleich des hydrodynamischen Radius mit der bekannten hydrodynamischen Größe des Monomers liefert eine qualitative Information zur oligomeren Verteilung in Abwesenheit konzentrationsabhängiger thermodynamischer Effekte.
Eine dritte intrinsische Eigenschaft, die dazu verwendet werden kann, qualitative Informationen zur oligomeren Verteilung zu liefern, ist die prozentuale Polydispersität. Dieser Wert wird im Verlauf einer DLS-kD-Messung abgeleitet (%Pd = Pd/Größe). Obwohl DLS keine Oligomere auflösen kann, ist die Breite des Spitzenwerts der intensitätsgewichteten Größe sehr empfindlich für das Vorhandensein oligomerer Spezies. Als Faustregel für monomere Proteinproben gilt, dass %Pd kleiner als 15 bis 20 % sein sollte. Ein größerer %Pd-Wert ist ein klarer Indikator für das Vorhandensein oligomerer Komponenten.
Im Idealfall würden MW und RS sowie die aufgelöste oligomere Verteilung und die prozentuale Reinheit über Lichtstreuung gekoppelt mit Größenausschluss-Chromatographie (SEC-LS) gemessen werden, und in der Praxis ist das auch oft der Fall. Dennoch sind die zum Generieren dieser Werte erforderlichen Daten (ohne zusätzliche Experimente) bereits verfügbar, sobald die Messung von kD und B22 durchgeführt wird. Dies macht sie zusammen mit der Abwesenheit von SEC-Säulenbeschränkungen zu nützlichen Parametern, die ermittelt und in ein Stabilitätsprofil aufgenommen werden sollten.
Die Nettoladung (Z) wird aus der mit ELS gemessenen elektrophoretischen Mobilität (µE) und dem mit DLS gemessenen hydrodynamischen Radius (RS) berechnet, wie aus dem unten gezeigten Ausdruck ersichtlich ist, in dem h die Viskosität repräsentiert, κ für die inverse Debye-Länge, f(κRS) für die Henry-Funktion und ZEff für die effektive Ladung auf der Gleit- oder Wechselwirkungsebene steht.
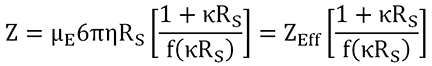
|
Die Nettoladung ist vom Standpunkt der kolloidalen Stabilität aus betrachtet der Hauptfaktor. Je größer die Nettoladung, desto größer ist die elektrostatische Abstoßung zwischen gleichen Partikeln. Bei Antikörpern und anderen Proteinen ist die Nettoladung ganz besonders wichtig aufgrund der Heterogenität der Oberflächenladung, die bei den für Biotherapeutika typischen höheren Konzentrationen zu attraktiven Dipol-Dipol-Wechselwirkungen führen kann. Bei Antikörpern mit großen Dipolmomenten muss die Nettoladung groß genug sein, um diesen attraktiven Wechselwirkungen entgegenzuwirken, da andernfalls bei einer hohen Probenkonzentration Aggregation und erhöhte Viskosität wahrscheinlich sind. Als generelle Faustregel gilt, dass eine effektive Ladung von 4 bis 6 in der Regel auf eine gute kolloidale Stabilität bei mAb-Rezepturen hinweist, während eine effektive Ladung von mehr als 6 auf ausgezeichnete Stabilität hinweist.
Die unten stehende Tabelle zeigt einen Vergleich der Nettoladungen und der effektiven Ladungen für das vorherige Beispiel mit IgG in den Puffern 1, 2, und 3. Diese Proben sind nach abnehmender Stabilität gemäß der Vorhersage durch den zweiten Virialkoeffizienten angeordnet. Ein 4. Puffer, PBS ohne Stabilisator, der als „#4“ gekennzeichnet ist, wurde zu Diskussionszwecken ebenfalls aufgenommen.
# | B22(ml mol/g2) | kD(ml/g) | ZEff | ZNet | Kolloidale Stabilität |
|---|---|---|---|---|---|
2 | 127,5 x 10-5 | 31,9 | 4,3 | 9,1 | Gut |
3 | 10,4 x 10-5 | -9,7 | 1,6 | 6,3 | Schlecht |
4 | 2,3 x 10-5 | -4,7 | -0,5 | -1,1 | Schlecht |
1 | -1,5 x 10-5 | -5,2 | 0,7 | 3,3 | Schlecht |
Wie in der oben stehenden Tabelle zu sehen ist, sind die Vorhersagen zur effektiven Ladung generell mit den B22-Vorhersagen konsistent und weist nur Puffer 2, die Probe mit einem großen positiven B22-Wert, auf eine gute kolloidale Stabilität hin. Bei niedrigeren Werten jedoch (z.B. bei den Puffern 1 und 4) ist die Ladung ein weniger effektiver Indikator, da in diesem Bereich die Dipol-Dipol-Wechselwirkungen zu einem Faktor werden. Diese Dipol-Dipol-Effekte werden bei thermodynamischen B22-Werten, aber nicht bei Werten der Nettoladungen oder effektiven Ladungen berücksichtigt.
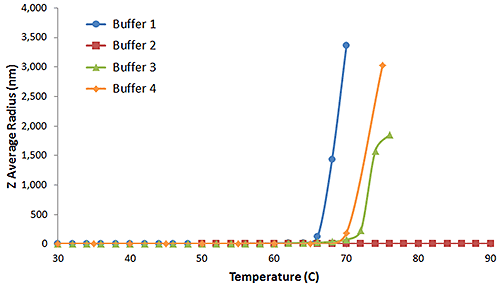
Die Temperatur des Beginns der Proteinaggregation (Tonset) ist die Mindesttemperatur, die erforderlich ist, um in einer Proteinrezeptur Aggregation zu erzeugen. Infolge der R6-Abhängigkeit der Streuintensität lassen sich mit Lichtstreuungsverfahren subtile Änderungen im Aggregationszustand einer Proteinrezeptur leicht erkennen. Abbildung 5 zeigt die DLS-Temperaturrampen für das vorherige IgG in den Puffern 1, 2, 3 und 4.
|
Wie aus der oben stehenden Abbildung zu ersehen ist, führt Aggregation zu einer starken Zunahme der durchschnittlichen Z-Größe, wodurch Tonset für IgG in den Puffern 1, 3 und 4 klar definiert wird. Puffer 2 dagegen zeigt bis zu einer Temperatur von 90 °C kein Anzeichen einer Aggregation.
Die Schmelztemperatur (Tm) ist die Temperatur, bei der die Proteinentfaltung stattfindet. Daher weist Tm auf die inhärente strukturelle Stabilität des gefalteten Proteins hin und würde TA in Abwesenheit von Denaturierung auf die kolloidale Stabilität hinweisen. Dennoch neigt Tonset dazu, auf Tm zu folgen, und ist in der Regel eine direkte Folge der Tm-Denaturierung statt eines Verlusts der kolloidalen Stabilität. Tatsächlich kann Tonset nur dann, wenn es sich vor Tm befindet, als ein Stabilitätsindikator verwendet werden, obwohl die Verwendung von Tm als ein Indikator für inhärente strukturelle Stabilität bei biologischen Rezepturen bereits Routine ist.
Die Menge des von einer Probe gestreuten Lichts ist proportional zum Quadrat des Molekulargewichts und zum Quadrat des Brechungsindexinkrements (dn/dC), das proportional zur molekularen Dichte oder zum partiellen spezifischen Volumen ist. Wenn sich Proteine entfalten, dehnen sie sich aus, was zu einer Zunahme der Größe und einer Abnahme von dn/dC führt. Daher kann Lichtstreuung auch dazu verwendet werden, thermisch verursachte Denaturierung zu überwachen. Betrachten Sie als Beispiel Abbildung 6, die erweiterte Ansichten der DLS-Temperaturrampen für IgG in den Puffern 1 und 4 und die gleichzeitig gemessene Streuintensität zeigt.
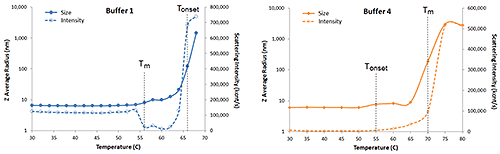
|
In Puffer 1 ist bei 66 °C eine starke Zunahme der hydrodynamischen Größe zu erkennen, was auf eine thermisch verursachte Aggregation und somit auf Tonset hinweist. Vor Tonset jedoch ist bei 56 °C eine kleine Zunahme der Größe zu erkennen, die von einer starken Abnahme der Streuintensität begleitet wird. Die kleine Zunahme der Größe könnte das Ergebnis einer Selbstassoziation oder einer vollständigen oder partiellen Entfaltung sein. Die Abnahme der Streuintensität jedoch lässt eine Verringerung des Brechungsindexdifferentials (dn/dC) vermuten, die auf Entfaltung hinweisen würde, wodurch 56 °C dann TM sein würde. In Puffer 4 sind Tm und Tonset umgekehrt und wird die kleine Zunahme der Größe bei 55 °C von einer Zunahme der Streuintensität begleitet. Diese Zunahme lässt eine Zunahme des Molekulargewichts vermuten, die wahrscheinlich durch die thermisch verursachte Selbstassoziation vor der Denaturierung und der nachfolgenden Agglomeration bei 70 °C (Tm) verursacht wird. Dieses frühe Tonset-Ereignis (z.B. pre-Tm) wird je nach Forschungsgruppe manchmal als Anfangs-Tonset oder sogar als Tonset-Verbindung bezeichnet, während der singuläre Deskriptor Tonset für den Beginn der Massenagglomeration vorbehalten ist.
Während die oberen Viskositätsgrenzen für die Herstellung und die subkutane Injektion von Biotherapeutika unternehmensabhängig sind, gelten Werte von ungefähr 20 cP bzw. 10 cP für Verarbeitung bzw. subkutane Injektion (SubQ) als typisch. Bei den für antikörperbasierte Biotherapeutika typischen hohen Konzentrationen kann es eine schwierige Aufgabe sein, die Formulierungsbedingungen zu optimieren, um diese Grenzen nicht zu überschreiten. Während die an früherer Stelle behandelten Lichtstreuungsindikatoren dabei von Nutzen sein können, in Frage kommende Formulierungen und Formulierungsbedingungen, die problematisch sein werden, auszufiltern und sogar erfolgreiche in Frage kommende Formulierungen hinsichtlich ihrer Stabilität und Herstellbarkeit in eine Rangfolge einzustufen, muss die Viskosität der Formulierung letztendlich gemessen werden. Abbildung 7 zeigt die Konzentrationsabhängigkeit der mit Mikrokapillarviskometrie gemessenen Viskosität von IgG in den Puffern 1 und 2. In Übereinstimmung mit den Lichtstreuungsindikatoren ist Puffer 2 mit Konzentrationsgrenzen von 148 mg/mL und 176 mg/mL für SubQ bzw. Verarbeitung am stabilsten. Im Vergleich dazu zeigt IgG in Puffer 1 Konzentrationsgrenzen von 137 mg/mL und 153 mg/mL für SubQ bzw. Verarbeitung.
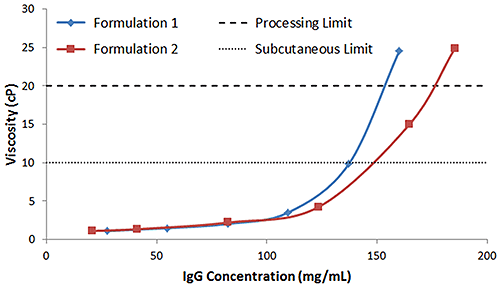
|
Das Stabilitätsprofil eines in Frage kommenden Biotherapeutikums ist eine Sammlung von Stabilitätsindikatoren und Deskriptoren, die Einblicke in die Entwicklungsfähigkeit und Herstellbarkeit der biologischen Rezepturen liefern. Unten ist das resultierende Stabilitätsprofil für das in diesem Bericht untersuchte IgG in den Puffern 1 und 2 zu sehen. Die grüne, gelbe und rote Kodierung bedeutet „Okay“, „Achtung“ und „Nicht okay“, während „RSA“ und „CR“ reversible Selbstassoziation und Ladungsabstoßung repräsentieren. Während spezifische Ziele von dem jeweiligen Unternehmen und Untersuchungsprogramm abhängig sind, sind die in diesem Beispiel gezeigten Werte in angemessenem Grad für typische Zielwerte repräsentativ. Dennoch sind die Schlussfolgerungen zur Entwicklungsfähigkeit und Herstellbarkeit in diesem Beispiel etwas willkürlich gezogen.
Tabelle 2. Stabilitätsprofile biologischer Rezepturen - IgG in Puffer 1 und 2.
Ziel | Puffer 1 Tween 80 | Puffer 2 Asparaginsäure | |
|---|---|---|---|
PSD | CR | RSA | CR |
Pd-Trend |
| Konstant | |
kD (mL/g) | > 15 | -5,2 | 31,9 |
B22 (x 105 ml mol/g2) | > 30 | -1,5 | 127,5 |
ZEff | > 5 | 0,7 | 4,3 |
Tm (°C) | > 70 | 56 | -- |
Tonset (°C) | ≥ TM | 66 | > 90 |
RS (nm) | 5,5 | 5,8 | 5,7 |
Oligomeres MW (kDa) | < 150 | 150,2 | 148,6 |
%Pd (als C
| < 20 | 35 | 32 |
SubQ-Grenze (mg/mL) | > 150 | 137 | 148 |
Verarbeitungsgrenze (mg/mL) | > 150 | 153 | 176 |
Relative Stabilität | Puffer 1 < Puffer 2 | ||
Entwicklungsfähigkeit | Niedrig | Mittelmäßig | |
Herstellbarkeit | Niedrig | Mittelmäßig | |
Obwohl die Liste nicht erschöpfend ist, lassen sich die in Tabelle 2 (oben) enthaltenen Parameter leicht aus mit Lichtstreuungs- und Viskositätsverfahren gemessenen Parametern extrahieren. Diese Parameter bilden die Ausgangsbasis für ein vorhersagefähiges Stabilitätsprofil, das sich leicht durch eine Integration oder Korrelation mit zusätzlichen Parametern wie z.B. Aggregationsraten, DSC-Ergebnissen, höherwertiger Struktur und anderen Eigenschaften, die für das Profil einer bestimmten Zielbiotherapeutikarezeptur relevant sind, verbessern lässt.
Die Initiative von Malvern Instruments zur biowissenschaftlichen Entwicklung wurde ins Leben gerufen, um die Innovation, Entwicklung und Förderung neuartiger Technologien, Produkte und Fähigkeiten zur Erfüllung bisher nicht gedeckter Messungsbedürfnisse in den biowissenschaftlichen Märkten zu beschleunigen.