In dieser Application Note ermöglichten ITC und DSC die Charakterisierung der Protein-Hilfsstoff-Bindung - eine der vielen möglichen Wechselwirkungen in einer komplexen Protein-Lösungsformulierung.
Biopharmaceutical Technologies, GlaxoSmithKline R&D, 709 Swedeland Rd,
King of Prussia, PA 19406 (USA)
Die Entwicklung proteinbasierter Therapeutika ist eine anspruchsvolle Aufgabe. Inhärente Proteininstabilitäten können sich als physikalische Instabilitäten (Entfaltung, Aggregation, Adsorption) und chemischer Zerfall (Oxidation, Deamidierung, Spaltung) manifestieren. Solche Instabilitäten können zu einer verringerten Aktivität des Proteins oder sogar zur Bildung potenziell immunogener Spezies führen. Ein Ansatz für die Stabilisierung eines Proteins ist die Änderung der Eigenschaften des damit in Kontakt stehenden Lösungsmittels. Dies kann anhand einer sorgfältigen Auswahl des Puffersystems, der Anpassung des pH-Werts und der Zugabe von Hilfsstoffen/Additiven erfolgen (d. h. durch Entwicklung einer optimalen Formulierung).
Ein wichtiger Faktor bei der lösungsmittelbasierten Stabilisierung von Proteinwirkstoffen ist die Auswahl der geeigneten Hilfsstoffe. Ebenso wichtig ist die Optimierung der Hilfsstoffkonzentrationen, die eine verlängerte Haltbarkeit und gleichzeitig höchste Sicherheit für den Patienten gewährleisten müssen. Somit ist ein wichtiger Teil der Formulierungsentwicklung für Proteinwirkstoffe die Auswahl von Hilfsstoffen, die eine geeignete Löslichkeit aufweisen, nicht toxisch sind, die strukturelle Integrität des Proteins bewahren, eine akzeptable Haltbarkeit des Produkts ermöglichen und seine biologische Aktivität erhalten. Diese Hilfsstoffe können Aminosäuren, Salze, Metalle, Netzmittel, Zucker und Polyole sowie Polymere umfassen. Sie können als Stabilisatoren, grenzflächenaktive Substanzen, antimikrobiellen Mittel oder Antioxidantien dienen. Ihre stabilisierende Effekte sind in der Regel proteinspezifisch und konzentrationsabhängig.
Im Zuge der Hilfsstoffauswahl werden Informationen zur optimalen Hilfsstoffkonzentration und auch zu den Wechselwirkungen zwischen den verschiedenen Bestandteilen der Formulierung benötigt. Die Optimierung der Auswahl und Konzentration der einzelnen Hilfsstoffe kann ein arbeitsintensiver Prozess sein, der umfangreiche Formulierungs-Screenings und Stabilitätsuntersuchungen erfordert. Die allgemeinen Prinzipien der Stabilisierung haben sich im Laufe des letzten Jahrzehnts in der Literatur niedergeschlagen (1). Die Mechanismen, durch die Hilfsstoffe die Stabilität eines Proteins bei der Lagerung verbessern können, sind noch unzureichend geklärt. Wenn die Mechanismen der Protein-Hilfsstoff-Wechselwirkungen bekannt sind, können gegenüber einem rein empirischen Screening-Ansatz das rationale Design und die Optimierung von Proteinformulierungen den Vorzug erhalten. Damit verringert sich auch der Zeit- und Materialaufwand für die Entwicklung von Proteinprodukten. Informationen zur Stärke und zur Art von Protein-Hilfsstoff-Wechselwirkungen würden zudem helfen, das In-vivo-Verhalten des Proteinwirkstoffs vorherzusagen.
Für das Hilfsstoff-Screening im Rahmen der Formulierungsentwicklung haben sich biophysikalische Analyseverfahren als äußerst nützlich erwiesen. Im Besonderen ist die Kalorimetrie eine der effizientesten Methoden, um die Proteinstabilität und Wechselwirkungen zu bewerten. Sie ermöglicht eine vollständige thermodynamische Charakterisierung des Systems (vorausgesetzt, dass alle Ereignisse reversibel sind). Beim Design und bei der Optimierung biopharmazeutischer Formulierungen wurden kalorimetrische Untersuchungen in zunehmendem Maße zur Aufklärung der Protein-Hilfsstoff-Wechselwirkungen eingesetzt. Die Kalorimetrie basiert auf der Bestimmung der Energetik und Stöchiometrie makromolekularer Wechselwirkungen durch Messung der Wärmemengenänderungen infolge von Assoziation, Dissoziation und/oder Entfaltungsprozessen. Die ITC wird in erster Linie zur Bestimmung der thermodynamischen Bindungsparameter eingesetzt. Hierzu gehören die Bindungsaffinität und Dissoziationskonstanten sowie Stöchiometrie, Enthalpie, Entropie und die Gibbs-Energie der Bindung unter isothermalen Bedingungen. Sie kann auch zur Bestimmung der Wärmekapazitätsänderung bei erfolgter Bindung eingesetzt werden, da sie Experimente über einen großen Temperaturbereich ermöglicht. Die DSC-Daten liefern die thermodynamischen Parameter der Proteinentfaltung, einschließlich von Entfaltungsmittelpunkttemperatur, Enthalpie, Entropie, Gibbs-Energie und Wärmekapazitätsänderungen bei Entfaltung.
Anhand dieser thermodynamischen Parameter kann z. B. ein Vergleich der Proteinstabilität in unterschiedlichen Formulierungen oder die Bestimmung der relativen stabilisierenden oder destabilisierenden Effekte bestimmter Hilfsstoffe erfolgen.
Diese Application Note beschreibt anhand eines Beispiels, wie die Formulierungsentwicklung für ProX von der Kalorimetrie profitierte, indem sie Einblicke in die Hilfsstoff-Protein-Wechselwirkungen ermöglichte. Hier werden Polysorbat-80 und Phenol als potenzielle Additive für den ProX-Formulierungspuffer untersucht. Polysorbat-80 ist ein Netzmittel, das häufig eingesetzt wird, um eine nicht spezifische Adsorption und Aggregation von Proteinen zu verhindern. Es wurde bereits früher gezeigt, dass es mit Proteinen interagiert (2, 3). Es schützt das Protein vor einer oberflächeninduzierten Aggregation, indem es an exponierte hydrophobe Regionen auf der Oberfläche des Proteinmoleküls bindet (3). Die gebräuchlichsten Konzentrationen von Polysorbat-80 liegen im Bereich 0,002 bis 0,1 % (w/v). Phenol wird als antimikrobielles Mittel für Formulierungen eingesetzt, bei denen eine Mehrfachdosierung aus demselben Behälter vorgesehen ist. Phenol ist toxisch. Daher muss die im Formulierungspuffer verwendete Konzentration minimiert werden. Die gebräuchlichsten Konzentrationen liegen im Bereich 0,3 bis 0,5 % (v/v).
Die Experimente wurden mit einem MicroCal™ VP-Capillary DSC durchgeführt. Von jeder Probe und dem entsprechenden Puffer wurden 400 µl in eine 96er-Mikrotiterplatte eingebracht. Die Proben wurden in einem Durchlauf von 25 ° bis 100 °C bei einer Durchlaufrate von 60 K/h gemessen. Den einzelnen Durchläufen ging eine Stabilisierungszeit von jeweils 15 Minuten voraus. Nach Puffersubtraktion und Konzentrationskorrektur des Proteindurchlaufs wurden die Daten mit der Software Origin für DSC, Version 7, analysiert.
Die Experimente wurden mit einem MicroCal iTC200 durchgeführt. Die Probenzelle wurde mit 250 µl ProX befüllt (10 oder 25 mg/ml), die Titrantspritze mit 40 µl Phenol (60 mM) oder Polysorbat-80 (50 mM), im gleichen Puffer wie ProX. Die Referenzzelle wurde mit deionisiertem Wasser befüllt. Für jedes Experiment wurden 40 µl des Titranten in Aliquoten von 0,2 bis 2 µl mit einer Rate von 0,5 µl/s in die Probenzelle injiziert. Es wurden folgende Einstellungen verwendet: Rührgeschwindigkeit 1000/min, Referenzleistung 5 bis 8 μCal/s, „Feedback Mode/Gain“ auf „high“, Temperatur 25 °C, Anfangsverzögerung 60 s. Von jedem Experiment wurden Kontrolldurchläufe mit Puffer in Puffer, Titrantlösung und ProX-Lösung subtrahiert. Die Daten wurden mit der Version 7 von Origin für ITC analysiert. Bevor die Proben in die ITC-Durchläufe eingebracht wurden, wurden sie gefiltert. Hierzu wurden 0,2 μm Spritzenfilter mit geringer Proteinbindung verwendet (Pall Life Sciences). Alle Proteinproben wurden gegen denselben Puffer dialysiert, der auch zur Präparation der Hilfsstofflösung eingesetzt wurde. Auf diese Weise wird die Übereinstimmung der Puffer in Spritze und Zelle gewährleistet.
Die direkte Bindung von Hilfsstoffen an den Wirkstoff eines pharmazeutischen Produkts kann sich in vielfältiger Weise auf das Produkt auswirken. Jüngste Untersuchungen haben gezeigt, dass gängige Hilfsstoffe in pharmazeutischen Formulierungen die Pharmakokinetik der Wirkstoffe beeinflussen können (4, 5). Hilfsstoffe können möglicherweise die Struktur oder die Bioverfügbarkeit des Proteinwirkstoffs ändern, was Veränderungen der Potenz zur Folge hätte. Zusätzlich zu einer möglichen Veränderung der Pharmakokinetik oder Potenz des Wirkstoffs können sich Hilfsstoff-Protein-Wechselwirkungen auch auf die Haltbarkeit oder die Sicherheit des Arzneimittels auswirken. Daher muss die Wechselwirkung zwischen Proteinen und den Formulierungshilfsstoffen erkannt und verstanden werden. Falls beim Design der Formulierung für einen Proteinwirkstoff eine direkte Wechselwirkung (d. h. eine nachweisbare Bindung) zwischen dem Protein und den Lösungshilfsstoffen festgestellt wird, müssen zwei wichtige Aspekte berücksichtigt werden. Erstens die Stärke und/oder die Reversibilität der Bindung des Hilfsstoffs an das Protein. Hierdurch könnte nach klinischer Verabreichung eine kritische aktive Bindungsstelle auf der Proteinoberfläche beeinträchtigt oder vollständig maskiert werden. Zweitens die Konzentration des ungebundenen Hilfsstoffs, die ausreichend sein muss, um die gewünschten Lösungseigenschaften zu erzielen. Am Beispiel von ProX werden beide Aspekte nachfolgend veranschaulicht.
Abbildung 1 zeigt die Ergebnisse eines ITC-Experiments, bei dem 50 mM Polysorbat-80 in 25 mg/ml ProX injiziert wurde. Feld (A) enthält die Rohdaten, Feld (B) die Wärmemenge pro Injektion nach Subtraktion der Kontrollmessungen. Die Daten in Feld (B) zeigen, dass tatsächlich eine nachweisbare Wechselwirkung zwischen Polysorbat-80 und ProX besteht. Die Daten wurden an ein Einstellenmodell mit der Bindungsaffinitätskonstante (KA) = 1430 ± 260 M-1, der Bildungsenthalpie (ΔH) = -6,3 ± 1,1 kcal/mol und der Anzahl der Bindungsstellen (n) pro ProX-Molekül = 2,6 ± 0,3 angepasst. Die Entropieänderung der Bindung (ΔS) wurde zu -6,7 ± 3,7 cal/mol-K berechnet.
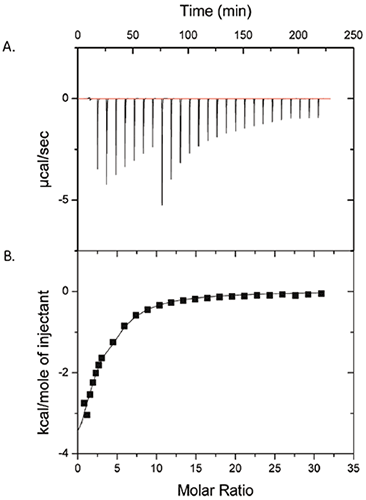
|
Aus der Isotherme (Abb. 1) wurde geschlossen, dass die Polysorbat-80-Bindungsstellen an ProX bei einem molaren Verhältnis von Polysorbat-80 pro ProX-Molekül von ca. 10 gesättigt waren. Die kritische Mizellenkonzentration (CMC) von Polysorbat-80 beträgt in reinem Wasser 0,012 mM und in Proteinlösungen laut Literatur auf bis zu 0,1 mM (2). Die Polysorbat-80-Konzentration in dem ITC-Experiment von Abbildung 1 umfasste 0,1 bis 7 mM. Damit lag sie selbst nach der ersten Injektion über dem CMC-Wert. Diese Informationen sind wichtig, da jede nachweisbare Wechselwirkung der Bindung des Proteins an die Netzmittelmizellen und nicht an das Monomer zugeschrieben werden würde.
In der Formulierungsentwicklung ist die Kenntnis der Bindungsparameter hilfreich, um die niedrigste Konzentration des gebundenen Hilfsstoffs zu bestimmen, bei der eine Sättigung des Proteins und ein stabilisierender Effekt bewirkt werden. Die Minimierung der Konzentration von Hilfsstoffen in einer Formulierung reduziert die Kosten und auch die Menge an Additiven, die dem Patienten verabreicht wird. In dieser speziellen Falluntersuchung war ein 10-facher molarer Überschuss von Polysorbat-80 pro Proteinmolekül ausreichend, um das Protein zu sättigen. Anhand der Bindungsparameter kann auch das In-vivo-Verhalten des Protein-Hilfsstoff-Komplexes vorhergesagt werden. Die mittels ITC gemessene niedrige Bindungsaffinitätskonstante lässt darauf schließen, dass der ProX-Polysorbat-80-Komplex bei Eintritt in den Blutkreislauf aufgrund der Verdünnung dissoziiert. Somit hat er dann keine Auswirkung auf die biologische Aktivität des Proteinwirkstoffs.
Phenol wird in der ProX-Formulierung als antimikrobielles Mittel eingesetzt. Hier wurde die ITC eingesetzt, um die Thermodynamik von evtl. nachweisbaren Bindungen zwischen dem Protein und dem Konservierungsmittel zu bewerten. Abbildung 2 zeigt den grafischen Auftrag der Wärmemenge pro Injektion gegen das Molverhältnis für die Titration von 60 mM Phenol in 10 mg/ml ProX bei pH 5,7, pH 4,5 und pH 3,5 nach Subtraktion der Kontrollmessungen.
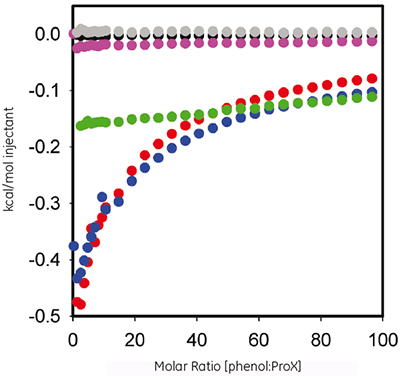
|
Die ITC-Daten zeigen, dass ProX in pH 5,7 und pH 4,5 mit Phenol interagiert, nicht jedoch bei pH 3,5. Die resultierenden Isothermen konnten an keines der vordefinierten Bindungsmodelle angepasst werden. Dies weist darauf hin, dass das Bindungsereignis komplex ist und mehrere Bindungsstellen umfasst.
Abbildung 3 zeigt die DSC-Kurven für 1 mg/ml ProX in den gleichen Formulierungspuffern, wie sie für die ITC-Experimente verwendet wurden. Die entsprechenden DSC-Daten zeigen, dass ProX in Abwesenheit von Phenol bei pH 5,7 mindestens drei Entfaltungsübergänge aufweist. Die Entfaltungsmittelpunkttemperaturen Tm1, Tm2 und Tm3 betrugen 59 °C, 68 °C und 85 °C. Der mittlere Übergang repräsentiert das primäre Entfaltungsereignis. Die Gesamtenthalpie der Entfaltung (ΔHunf) betrug 270 kcal/mol. Bei pH 4,5 war der erste Übergang nicht nachweisbar. Das primäre Entfaltungsereignis wies einen Tm2-Wert von 55 °C auf, und Tm3 fiel auf 73 °C. Der ΔHunf-Wert fiel auf 216 kcal/mol, was auf eine Verminderung der Stärke tertiärer Wechselwirkungen schließen lässt. Bei pH 3,5 schließlich war ProX säurebedingt ungefaltet, wie anhand des Fehlens nachweisbarer Entfaltungsübergänge in den DSC-Daten zu erkennen ist.
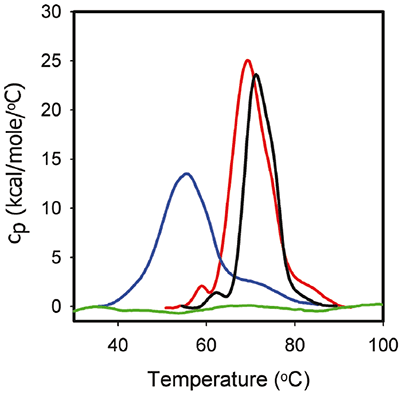
|
Abbildung 3 zeigt auch das DSC-Thermogramm der ProX-Entfaltung in Gegenwart von Phenol bei pH 5,7. Es ist festzustellen, dass durch Phenol der Tm1-Wert um 1 K und der Tm2-Wert um 2 K erhöht wurden, während der ΔHunf-Wert auf 195 kcal/mol fiel. Die Tertiärstruktur von ProX blieb jedoch in Gegenwart und in Abwesenheit von Phenol identisch (bestimmt wurde dies anhand zusätzlicher biophysikalischer Charakterisierungsdaten z. B. aus Fluoreszenzmessungen; Daten nicht gezeigt). In der Regel können Veränderungen des DSC-Verhaltens mit strukturellen Veränderungen korreliert werden, die anderen Verfahren nachgewiesen werden. Die ist jedoch nicht immer der Fall. Es wird angenommen, dass die DSC-Veränderungen auf die Störung der Kräfte zurückzuführen sind, die die native Proteinstruktur stabilisieren (wie z. B. Van-der-Waals-Kräfte, hydrophobe und elektrostatische Wechselwirkungen, Wasserstoffbrücken usw.), sowie auf die Hydratation der exponierten Residuen. Durch die Destabilisierung der tertiären Wechselwirkungen könnte die (mittels DSC gemessene) Kompaktheit des Proteins verringert werden. Und dies, ohne dass strukturellen Veränderungen induziert werden, die mit anderen analytischen Verfahren nachweisbar sind.
Diese Kombination aus ITC- und DSC-Daten lieferte wichtige Informationen über die Phenol-Protein-Wechselwirkungen. 1. Phenol bindet an das gefaltete ProX, bindet jedoch nicht an das ungefaltete ProX (Abb. 2). Es ist daher wichtig, dass die Tertiärstruktur intakt ist, damit ProX über verfügbare Bindungsstellen für Phenol verfügt. 2. Da es für die Funktionalität wichtig ist, dass die Tertiärstruktur des Proteins intakt ist, scheint der optimale pH-Wert der Formulierung bei 5,7 zu liegen. 3. Wie aus Abbildung 2 ersichtlich, erreicht die Bindung von Phenol an ProX die vollständige Sättigung bei molaren Verhältnissen über 50. 4. Bei der Durchführung der DSC-Messung (1 mg/ml ProX in pH 5,7 Formulierungspuffer mit 0,005 % Phenol (v/v)) wies das molare Verhältnis Phenol:ProX einen berechneten Wert von 38 auf. Dieser Wert lag nahe, jedoch nicht exakt bei der vollständigen Sättigung. 5. Obwohl die Bindungsstellen nicht gesättigt waren, war dieses molare Verhältnis von Phenol ausreichend, um die thermische Stabilität von ProX zu erhöhen.
Es wurde festgestellt, dass Phenol in Gegenwart von ProX eine verringerte antimikrobielle Aktivität aufweist (Daten nicht gezeigt). Kombiniert man diese Beobachtung mit der Tatsache, dass Phenol an ProX bindet, zeigt dies, dass gebundenes Phenol entweder keine oder eine verringerte antimikrobielle Aktivität im Vergleich zu ungebundenem Phenol aufweist. Unter Verwendung der Bindungskurve könnte für die Formulierung eine Phenolkonzentration über dem Sättigungsbindungspunkt gewählt werden, bei der die Konzentration von ungebundenem Phenol eine effektive antimikrobielle Aktivität ermöglichen würde. Die erhöhten Tm-Werte für ProX in Gegenwart von Phenol wurden ursprünglich nicht erwartet. Sie weisen aber auf eine verbesserte thermische Stabilität und eine bessere Langzeitstabilität des Proteins hin. Zwischen der phenolinduzierten Stabilisierung und der antimikrobiellen Wirksamkeit von Phenol kann kein direkter Zusammenhang hergestellt werden.
Mittels ITC und DSC wurde die Bindung von Phenol an gefaltetes ProX bei pH 5,7 bzw. von Polysorbat-80 an ProX identifiziert und thermodynamisch charakterisiert. Die gemessene Bindungskonstante für ProX an Polysorbat-80 klassifiziert eine schwache Wechselwirkung. Somit könnte die In-vivo-Dissoziation des aktiven Proteins von den stabilisierenden Hilfsstoffen in der Formulierung vorhergesagt werden, und ebenso eine nur minimale hilfsstoffinduzierte Beeinträchtigung der vollständigen biologischen Wirkung des Proteinwirkstoffs. Anhand der Sättigungskurve der ProX-Phenol-Titrationen kann eine Konzentration von Phenol über dem Sättigungspunkt ermittelt werden, um eine Formulierung mit optimalem antimikrobiellen Potenzial und verbesserter thermischer Stabilität zu entwickeln. Die vermutete Hilfsstoffbindung wurde bestätigt, und die geeigneten Konzentrationen dieser beiden Hilfsstoffe wurden bestimmt (ein 10-facher molarer Überschuss von Polysorbat-80 pro ProX-Molekül bei Konzentrationen über dem CMC-Wert sowie ein 50-facher molarer Überschuss von Phenol pro ProX-Molekül).
Zu den Anforderungen an Proteinproduktformulierungen gehören Sicherheit und Wirksamkeit. Die Zugabe von Hilfsstoffen zur Erzielung sicherer und wirksamer Proteintherapeutika sowie zur Verbesserung der Produktstabilität und Haltbarkeit setzt das Verständnis der Wechselwirkungen zwischen dem Protein und den Hilfsstoffen auf molekularer Ebene voraus. In dieser Application Note ermöglichten ITC und DSC die Charakterisierung der Protein-Hilfsstoff-Bindung - eine der vielen möglichen Wechselwirkungen in einer komplexen Protein-Lösungsformulierung.
Arakawa T. et al., Factors affecting short-term and long-term stabilities of proteins. Adv. Drug Deliv. Rev. 46, 307-326 (2001).
Chou D. K. et al., Effects of Tween 20 and Tween 80 on the stability of Albutropin during agitation. J. Pharm. Sci. 94, 1368-1381 (2005).
Bam N. B. et al., Tween protects recombinant human growth hormone against agitation-induced damage via hydrophobic interactions. J. Pharm. Sci. 87, 1554-1559 (1998).
Ren X. et al., Pharmaceutical excipients inhibit cytochrome P450 activity in cell free systems and after systemic administration. Eur. Jour. Pharm. Biopharm. 70, 279-288 (2008).
Taheri-Kafrani A. et al, T. Beta-lactoglobulin structure and retinol binding changes in presence of anionic and neutral detergents. J. Agric. Food Chem. 56, 7528-7534 (2008).