Anhand von DDK-Daten wurden die am besten stabilisierenden Elutionsbedingungen für die Phase der Antikörpererfassung in der Prozessentwicklung von Proteinen sowie die dadurch eingesparten Kosten bestimmt.
Die biopharmazeutische Prozessentwicklung kann kosten- und zeitaufwendig sein. Oberstes Ziel ist es, die Ausbeute des gereinigten Produkts zu maximieren, indem ein möglichst kosteneffektiver, reproduzierbarer und robuster Prozess angewendet wird. Da Chargenausfälle beträchtliche wirtschaftliche Folgen haben können, ist ein tief greifendes Verständnis der Proteinstabilität von grundlegender Bedeutung. Dies gilt für den gesamten Entwicklungsweg - von der Forschung über die klinische Entwicklung bis zur kommerziellen Herstellung.
Die Beibehaltung der Stabilität und der aktiven Struktur eines Protein-Biopharmazeutikums bis zur Verabreichung ist ein entscheidender Faktor. Realisiert werden kann dies unter anderem durch Stabilitätsuntersuchungen, durch die das Verständnis des physikalischen Verhaltens von Biotherapeutika vertieft werden kann. Proteine weisen in der Regel inhärente Stabilitätsprobleme auf. Dies ist auf ihre Komplexität und ihre empfindliche Struktur zurückzuführen. Stabilitätsuntersuchungen zur Bestimmung der Auswirkungen verschiedener Umgebungsfaktoren, wie pH-Wert, Temperatur und Ionenstärke, auf die konformationelle Integrität eines Proteins, die direkten Einfluss auf die biologische Aktivität hat, sind bei der Prozessentwicklung unverzichtbar. Anhand dieser Belastungsuntersuchungen können kritische Merkmale ermittelt und die Schwachpunkte im Molekül aufgedeckt werden. Sie bieten einen rationalen Ansatz zur Identifizierung von Denaturierungsmechanismen und zur Entwicklung wirksamer Gegenmaßnahmen durch die Auswahl geeigneter Puffer, pH-Werte, Ionenstärken und Hilfsstoffe.
|
Die parallele Durchführung von Stabilitätsuntersuchungen ermöglicht es den Wissenschaftlern, effektivere Reinigungsverfahren zu entwickeln. Bei der Entwicklung von Reinigungsprozessen können durch Stabilitätsuntersuchungen folgende Aspekte abgedeckt werden:
Stabilitätsuntersuchungen unterstützen auch die Entwicklung robuster und stabilitätsanzeigender Assays. Diese Daten ermöglichen eine beschleunigte Entwicklung von Formulierungen für Wirkstoffe. Bei den typischen Untersuchungen zur Formulierungsentwicklung grenzen sie den Umfang der zu untersuchenden Bedingungen ein. Dies führt wiederum zur Einsparung von Ressourcen, Kosten und Zeit.
Diese Application Note befasst sich mit der dynamischen Differenzkalorimetrie (DDK) als Instrument zur Steuerung der Entwicklung von Antikörper-Reinigungsprozessen. Im Besonderen wird in dieser Application Note beschrieben, wie anhand von DDK-Daten optimale Elutionsbedingungen für die Entwicklung des Protein-A-Erfassungsschritts ermittelt wurden. Hierdurch ergaben sich Kosteneinsparungen in der Phase der frühen klinischen Herstellung.
Die DDK bietet die Möglichkeit, die Proteinstabilität während der gesamten Verarbeitung und Handhabung zu überwachen. Auf diese Weise können verbesserte Bedingungen erzielt werden, die das Molekül schützen, wenn bei der Verarbeitung oder Assay-Entwicklung atypische Bedingungen oder Proteinverhalten auftreten.
Alle Proteine wurden in dem angegebenen Puffer durch Dialyse oder Pufferaustausch mittels der Entsalzungssäule PD-10 (GE Healthcare) präpariert. Die endgültigen Proteinkonzentrationen betrugen ca. 1 mg/ml. Die Proteine wurden mit dem System MicroCal VP-DSC von Malvern analysiert. Dabei wurde ein Temperaturbereich von 5 °C bis 90 °C und eine Durchlaufrate von 1 K pro Minute verwendet. Die Analysen der Thermogramme wurden mit der Software Origin™ unter Verwendung eines Zweizustands- oder eines Nicht-Zweizustandsmodells durchgeführt.
Die Protein-A-Affinitätschromatographie wird bei der Reinigung monoklonaler Antikörper häufig für den ersten Erfassungsschritt eingesetzt. Protein-A bindet an die Fc-Region vieler Immunoglobulin-Antikörpermolekül (Ig). Aufgrund dieser Bindungsspezifität und -selektivität kann in einem einzigen Schritt ein nahezu reines Produkt erhalten werden. Die Antikörpermoleküle werden mittels Zellkultur hergestellt und müssen von Wirtszellenproteinen, Nukleinsäuren und Zellkulturkomponenten gereinigt werden. Dem Protein-A-Affinitätschromatographie-Medium werden zellfreie konditionierte Zellkulturmedien zugesetzt. Die Antikörper binden an das immobilisierte Protein-A bei einem neutralen pH-Wert (um pH 7) und eluieren mit einem Puffer mit niedrigem pH-Wert (z. B. Citratpuffer mit pH 3,5). Neutralisiert werden die eluierten Antikörper mit einer Lösung, die eine hohe Pufferkapazität aufweist,
wie 1 M TRIS (pH 9), oder durch Entsalzen.
Problematisch bei der Anwendung der Protein-A-Affinitätschromatographie ist, dass Antikörper ebenso wie andere Proteine bei den für die Elution erforderlichen niedrigen pH-Werten instabil sein können. Wenn das Protein bei niedrigen pH-Werten instabil ist, kann es während oder nach der Elution ausfällen.
Die Ausfällung ist in der Regel von der Proteinkonzentration abhängig: Eine hohe Konzentration begünstigt Aggregation und Ausfällung. Obwohl also die meisten Chromatographiemedien mindestens 20 g Antikörper pro Liter Medium binden können, wird die Stabilität des Proteins bei niedrigen pH-Werten, nach der Elution, zum limitierenden Faktor für die Beladung des Mediums. Wenngleich viele Antikörper pH-sensitiv sind, variiert der Mechanismus der Denaturation
und Aggregation abhängig von der Struktur. Daher werden für eine optimale Stabilität unterschiedliche Puffer benötigt.
Um die Beladungskapazität und die Wirtschaftlichkeit des Protein-A-Chromatographieprozesses zu verbessern, muss das Protein im Elutionspuffer stabilisiert werden. Mit der DDK kann die Stabilität des Antikörpers als Funktion des pH-Werts charakterisiert werden. Zudem kann bestimmt werden, welche Additive die Proteinstabilität bei niedrigen pH-Werten verbessern können. Eine Erhöhung der Übergangstemperatur (Tm) in der DDK lässt auf eine Erhöhung der Proteinstabilität schließen. Um den Protein-A-Chromatographieschritt wirtschaftlich rentabler zu gestalten, muss der Antikörper in dem Elutionspuffer mit niedrigem pH-Wert stabilisiert werden. Dadurch wird die Beladungskapazität erhöht.
In einem Feldversuch sollte der Reinigungsprozess für einen kundenspezifischen Antikörper (Antikörper X) verbessert werden. Den Prozessinformationen zufolge war die initiale Bindungskapazität auf 2 g von Antikörper X pro Liter Protein-A-Medium begrenzt, da bei höherer Beladung bei der Elution eine Ausfällung des Antikörpers erfolgte. Um die Auswirkung des pH-Werts auf Stabilität von Antikörper X zu verstehen, wurde das Protein in vier unterschiedlichen Puffern präpariert: Citratpuffer mit TRIS auf pH 7,0 angepasst, Phosphatpuffer mit pH 7,3; Citratpuffer mit pH 3,5 und Citratpuffer mit pH 5,0. In den DDK-Daten (Tabelle 1) zeigte Antikörper X bei pH 7,0 und 7,3 einen höheren Tm-Wert als bei pH 3,5. Dies belegt, dass das Protein bei höherem pH-Wert stabiler war. Die Temperaturen bei Entfaltungsbeginn waren bei pH 7,0 und 7,3 ebenso höher als bei pH 3,5. Bei pH 5,0 wies Antikörper X einen Tm-Wert auf, der mit dem Wert bei pH 7,0 vergleichbar war. Die Temperatur bei Entfaltungsbeginn war niedriger, was darauf schließen lässt, dass der pH-Wert bei der Entfaltung dieses Antikörpers eine wichtige Rolle spielt.
| Tm des Hauptübergangs | Beginn der Entfaltung (°C) | |
|---|---|---|
| Citrat-TRIS-Puffer, pH 7,0 | 68,7 | 60,1 |
| PBS, pH 7,3 | 69,5 | 58,5 |
| Citrat, pH 5,0 | 71,5 | 48,2 |
| Citrat, pH 3,5 | 59,3 | 34,1 |
| Citrat + Mannitol, pH 3,5 | 64,7 | 41,0 |
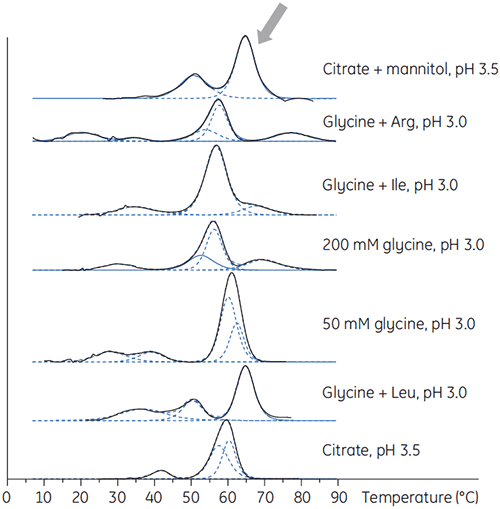
Antikörper X wurde auch in Puffern mit niedrigem pH-Wert präpariert. Dabei wurden verschiedene Additive verwendet, um zu bestimmen, ob eines dieser Additive den Antikörper bei niedrigen pH-Werten stabilisieren kann. Es wurden DDK-Experimente durchgeführt, um zu überprüfen, welche Bedingungen eine Erhöhung des Tm-Werts des Antikörpers bewirken würden (Abbildung 2).
|
Für Antikörper X bewirkte Citrat + Mannitol bei pH 3,5 die größte Tm-Verschiebung und damit die günstigste Stabilität. Die Zugabe von Mannitol verursachte eine Erhöhung des Tm-Werts und der Temperatur bei Entfaltungsbeginn relativ zu Citrat bei pH 3,5. (Abbildung 3).
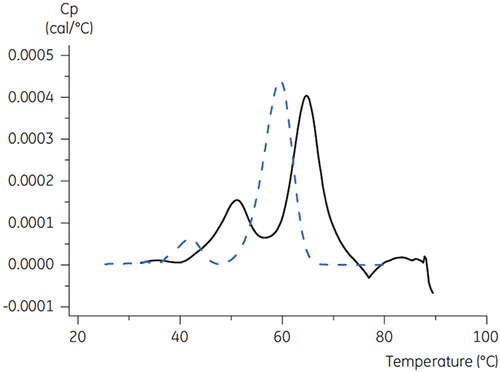
|
Die DDK-Ergebnisse ließen vermuten, dass die Zugabe von Mannitol zu dem Elutionspuffer für das Protein-A-Affinitätsmedium eine Verbesserung der Stabilität von Antikörper X bewirken würde. Durch eine verbesserte Antikörperstabilität bei der Elution kann die Beladung des Protein-A-Chromatographiemediums mit Antikörper erhöht werden.
Wenn für die Entwicklung der Prozesse die mittels DDK ermittelten Proteinstabilitätsinformationen genutzt wurden, konnte während des Protein-A-Erfassungsschritts eine erhöhte Beladung mit Antikörper X erzielt werden. Wurde für den Protein-A-Elutionspuffer Citrat + Mannitol verwendet, ergab sich eine mindestens 7,5-fache Steigerung der Kapazität auf ≥ 15 g von Antikörper X pro Liter Protein-A-Medium, im Vergleich zu 2 g pro Liter bei reinem Citratpuffer.
Nach dem Protein-A-Erfassungsschritt lag der Antikörper X in höherer Konzentration vor als in dem früheren Prozess. Somit konnte ein Ultrafiltrations-/Diafiltrationsschritt entfallen, woraus sich Einsparungen an Material und Verarbeitungszeit ergaben.
In dieser Application Note wurden anhand von DDK-Daten die am besten stabilisierenden Elutionsbedingungen für die Phase der Antikörpererfassung in der Prozessentwicklung von Proteinen bestimmt. Die DDK liefert wertvolle Informationen zur Auswahl der proteinstabilisierenden Pufferbedingungen, bevor mit der chromatographischen Entwicklung begonnen wird. Die Möglichkeit zur Leistungsverbesserung in diesem kritischen Schritt bei der Entwicklung von Reinigungsprozessen kann nachgelagert beträchtliche Kosteneinsparungen ergeben.
Autor dieser Application Note ist Prathima Acharya, ehemals tätig bei Diosynth Biotechnology. Dank gebührt Rochelle Bazemore, Sorina Morar, Sue Cook und Jessica Weaver von Purification Development Group für ihre Beiträge zu dieser Arbeit.