In dieser Application Note wurde das Malvern MicroCal VP-Capillary DSC für die schnelle Untersuchung von Puffern in der Präformulierungsentwicklung und für die Optimierung von Lagerbedingungen für Antikörper in der Prozessentwicklung eingesetzt. Die Ergebnisse zeigen eine gute Übereinstimmung mit denen anderer, zeitaufwendigerer Verfahren.
Biotherapeutika sind ein schnell wachsender Bereich in der pharmazeutischen Industrie. Dabei werden Antikörper und andere Proteinmolekülen zur Behandlung von Krankheiten eingesetzt. Biotherapeutika werden oft in hohen Konzentrationen und mehrfachen Dosen verabreicht. Die Hersteller müssen ihre Proteinwirkstoffe daher in Kilogrammmengen herstellen. Der Herstellungsprozess für Biotherapeutika umfasst die Proteinexpression in Bioreaktoren mit Volumen von mehreren Tausend Litern. Darauf folgt ein Reinigungsprozess, bei dem Chromatographiesäulen und Filtrationsgeräte in großem Maßstab eingesetzt werden.
Die Stabilität eines Proteins bei Prozessbedingungen, die Reversibilität konformationeller Änderungen und etwaige Tendenzen zur Aggregatbildung hängen von Faktoren wie dem pH-Wert und der Pufferzusammensetzung ab. Ein tief greifendes Verständnis dieser Faktoren ist wichtig für die Auswahl der Prozessbedingungen, der Formulierung und die Entwicklung von Analysemethoden. Der Antikörper-Reinigungsprozess umfasst Schritte, durch die ein Protein instabil werden kann. Dazu gehören Elutionsschritte bei niedrigem pH-Wert aus einer Protein-A-Säule, Halteschritte bei niedrigem pH-Wert zur Virusinaktivierung sowie alle Schritte mit niedrigem pH-Wert und/oder Ionenstärkeanpassung, einschließlich der endgültigen Formulierung.
Die dynamische Differenzkalorimetrie (DDK) liefert Informationen zur thermischen Stabilität eines Proteins unter Bedingungen mit unterschiedlichen pH-Werten und Kosoluten durch die Überwachung der Mittelpunkte des thermischen Übergangs (Tm). Ein höherer Tm-Wert bedeutet eine höhere thermische Stabilität, und diese korreliert gut mit der Langzeitstabilität. In dieser Application Note wird beschrieben, wie Diosynth Biotechnology die mittels DDK bestimmten Thermostabilitätsdaten verwendet, um die Stabilität eines Antikörpers zu charakterisieren. Anwendung ist das orientierende pH- und Puffer-Screening für die Präformulierungsentwicklung und die Optimierung der Virusinaktivierung bei niedrigem pH-Wert im Herstellungsprozess. Eine Virusinaktivierung bei niedrigem pH-Wert ist in der Proteinherstellung wünschenswert, wenn sie keine Verringerung der Proteinstabilität bewirkt.
Die DDK wurde unter Verwendung des Systems MicroCal VP-Capillary DSC von Malvern durchgeführt. In der Untersuchung zur Präformulierungsentwicklung wurde eine Reihe von Puffern mit pH-Werten zwischen 3 und 8 verwendet. Das Protein (Antikörper X) wird in den einzelnen Puffern gelagert, und Assays wurden sofort durchgeführt (t = 0) bzw. nach einer Woche der Lagerung (t = 1 Woche).
Zur Optimierung der Reinigungsbedingungen wurden DDK-Thermogramme von Antikörper Y (in einem neutralen TRIS-Puffer mit NaCl- und EDTA-Zusatz, pH 7,4) untersucht und mit einem pH 3 Citratpuffer und einem mit 2 M TRIS (pH 9,0) auf pH 6 angepassten Citratpuffer verglichen.
Die Thermogramme des Puffers alleine wurden von jedem Protein subtrahiert, bevor eine Analyse mit der Software Origin™ 7.0 und zusätzlicher Analysesoftware für das MicroCal VP-Capillary DSC erfolgte.
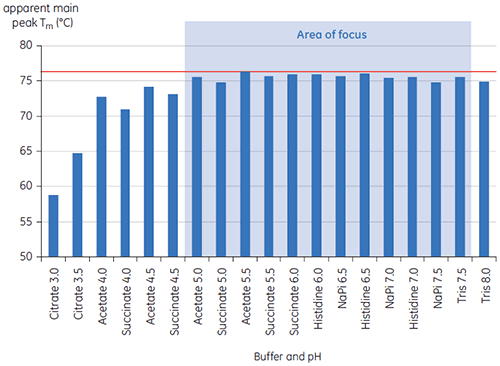
Die Werte des Tm-Hauptpeaks bei t = 0 für Antikörper X in der ersten Untersuchung von 19 Puffern für die Präformulierungsentwicklung sind in Abbildung 1 gezeigt. Die DDK-Thermogramme für den Antikörper in zwei dieser Puffer sind in Abbildung 2 gezeigt. Aus den Tm-Werten konnten die stabilsten Pufferbedingungen zwischen pH 5,0 und pH 7,5 ermittelt werden. Bei t = 0 ergaben andere analytische Verfahren (UV, Größenausschlusschromatographie (SEC), Lichtstreuung und SDS-PAGE) gegenüber der DDK deutlich weniger Unterschiede zwischen den Pufferbedingungen.
|
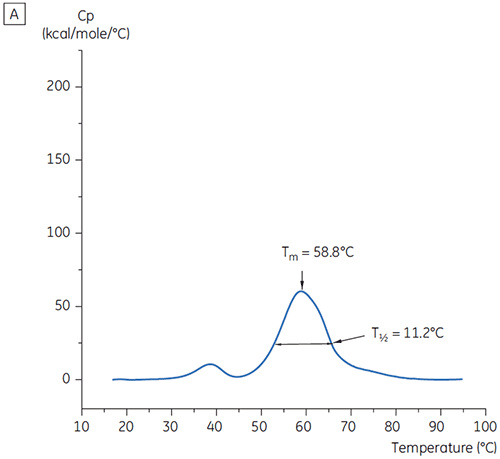
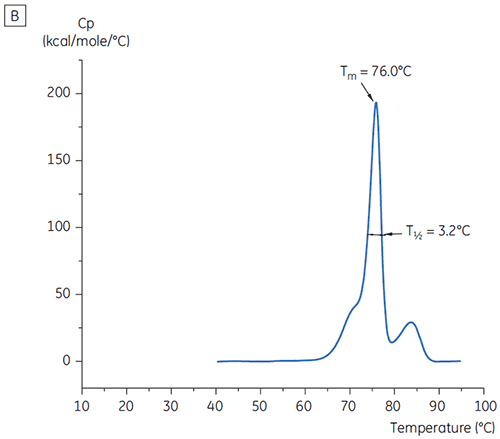
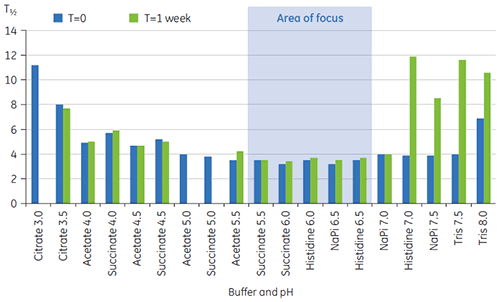
Eine weitere Unterscheidung der Bedingungen erfolgte anhand der T½-Werte; siehe Abbildung 2. Der T½-Wert entspricht der Peakbreite des Hauptübergangs im DDK-Thermogramm bei halber Maximalhöhe. Er spiegelt in der Regel die Kooperativität des thermischen Übergangs wider. Ein niedriger T½-Wert kann auf eine kompaktere Struktur hinweisen und wird daher für Formulierungen bevorzugt. Hier wurden die niedrigsten T½-Werte bei Puffern mit pH-Werten zwischen 5,5 und 6,5 ermittelt (Abbildung 3).
|
|
|
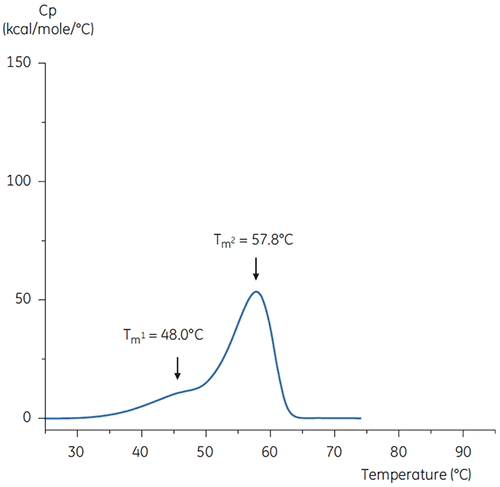
Citratpuffer bei pH 3 ist ein attraktiver Kandidat für die Elution des Antikörpers aus der Protein-A-Affinitätssäule und für den nachfolgenden Halteschritt bei niedrigem pH-Wert zur Virusinaktivierung. Da die meisten Proteine bei längerer Exposition gegenüber so niedrigen pH-Werten dazu tendieren, instabil zu werden, muss der pH-Wert unmittelbar nach dem Virusinaktivierungsschritt angehoben werden.
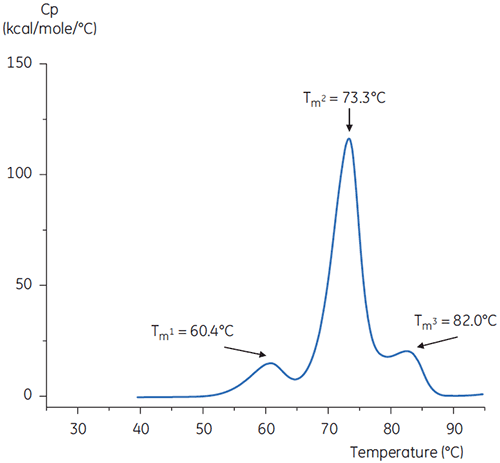
Die DDK-Durchläufe des Antikörpers in Puffer bei neutralem pH-Wert und bei pH 3 sind in den Abbildungen 4 und 5 gezeigt.
|
|
Die Unterschiede in Form und Verlauf der beiden Thermogramme belegen für den Antikörper in dem pH 3,0 Puffer einen Verlust an thermischer Stabilität. Die Peakhöhe des Tm2-Übergangs ist geringer, der Peak ist breiter, und die Abgrenzung zwischen dem ersten und zweiten Übergang in pH 3,0 ist weniger deutlich als bei pH 7,4.
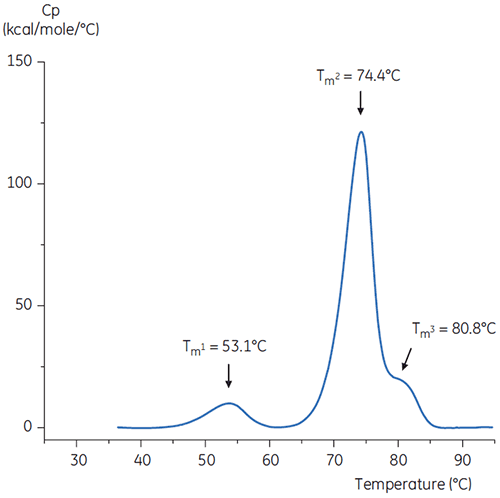
Um den pH-Neutralisierungsschritt nachzubilden, wurde der pH-Wert der Antikörperlösung mit einer konzentrierten TRIS-Lösung (pH 9) auf pH 6,0 angepasst. Das Thermogramm der resultierenden Antikörperlösung ist in Abbildung 6 gezeigt. Relativ zu dem Antikörper in pH 3,0 Puffer ist hier eine erhöhte thermische Stabilität zu erkennen. Die Tm2- und Tm3-Werte der Antikörper in der pH 6,0 Lösung sind ähnlich den Tm2- und Tm3-Werten der Antikörper im Referenzpuffer. Auch Gesamtform, Peak-Abgrenzung und Peakbreite für den Antikörper bei pH 6 sind ähnlich der Referenzsituation bei pH 7,4.
Die Neutralisierung kann auch in Gegenwart stabilisierender Hilfsstoffe wie Histidin erfolgen. In diesem Fall war das Thermogramm des Antikörpers bei einer Neutralisierung in Gegenwart von Histidin fast identisch mit Abbildung 6. Das lässt darauf schließen, dass Histidin bei diesem speziellen Antikörper keine signifikant stabilisierende Wirkung hatte.
|
Diese Untersuchung zeigt, dass die DDK zur schnellen Optimierung von pH-und Pufferbedingungen für die Präformulierungsentwicklung eingesetzt werden kann. Anhand dieser Daten wurden geeignete Puffer und pH-Bereiche für das nachfolgende Hilfsstoff-Screening klassifiziert, durch das die Anzahl der zu untersuchenden Bedingungen erheblich verringert wird.
Die DDK kann auch zur Überprüfung der Stabilität eines Antikörpers während eines Inaktivierungs-Halteschritts bei niedrigem pH-Wert und der nachfolgenden pH-Anpassung von pH 3,0 auf pH 6,0 eingesetzt werden. Diese Art von Stabilitätsinformationen ist nützlich für das Design und die Optimierung der biopharmazeutischen Produktionsprozesse.
Diese Daten wurden freundlicherweise zur Verfügung gestellt von Dr. Kathrine E. Bowers, FUJIFILM Diosynth Biotechnologies USA Inc.