Das Malvern MicroCal iTC200 bietet einen geringen Probenverbrauch und einen hohen Durchsatz und steigert so die Produktivität. In dieser Application Note wird der Einsatz dieses Geräts in einem Workflow beschrieben, der von der Assay-Entwicklung bis zur Leitsubstanzoptimierung reicht.
Das Ziel der pharmazeutischen Forschung ist es, die Aktivität eines Targets so zu modulieren, dass eine therapeutisch günstige Antwort hervorgerufen wird. Ein Arzneimittel ist in der Regel nur dann wirksam, wenn es an die Aktivität des physiologischen Targets gebunden ist und diese moduliert. Folglich konzentriert sich die Wirkstoffentdeckung in der frühen Phase weitgehend auf die Optimierung der Targetaffinität und -selektivität des Arzneimittelkandidaten.
Die isotherme Titrationskalorimetrie (ITC) wird weithin zur Messung der thermodynamischen Bindungsparameter für Wechselwirkungen zwischen kleinen Molekülen und Proteinen eingesetzt. Die gleichzeitige Messung der Bindungsaffinität (KD), Stöchiometrie (n), freien Energie (ΔG), Enthalpie (ΔH) und Entropie (ΔS) liefert in vielen Phasen der Arzneimittelentwicklung wichtige Informationen.
Die folgenden Beispiele veranschaulichen, wie die mit dem System MicroCal iTC200 gewonnenen, detaillierten Bindungsinformationen die verschiedenen Phasen der Arzneimittelentwicklung unterstützen.
Ein Beispiel umfasst die Untersuchung von Peptidbindungen an das Zielprotein bei der Assay-Entwicklung. Das Ziel ist hierbei ein besseres Verständnis der Bindungsmechanismen eines Zielproteins und damit eines potenziellen Wirkstoffs für zukünftige Arzneimittel. Des Weiteren können die resultierenden Daten, insbesondere Stöchiometrie (n) und Affinität (KD), zur Bewertung der Qualität und Aktivität nachfolgender Zielproteinpräparate herangezogen werden.
In einer zweiten Anwendung wird die ITC als orthogonale Methode zur Untersuchung der Bindung von Hits an das Zielprotein eingesetzt, nach einem primären Screening. Ein positives Ergebnis aus der ITC kombiniert mit Daten biochemischer Assays und Daten anderer biophysikalischer Methoden (z. B. Oberflächen-Plasmon-Resonanz (SPR) und Kernspinresonanz (NMR)) unterstützt die genaue Unterscheidung zwischen echten Hits und Falsch-Positiven.
In der abschließenden Untersuchung werden die Enthalpie- und Entropiebeiträge der freien Energie für Substanzen in der Leitsubstanzoptimierungsphase erforscht. Die gleichzeitige Messung der Bindungsaffinität (KD), Stöchiometrie (n), freien Energie (ΔG), Enthalpie (ΔH) und Entropie (ΔS) liefert wichtige Informationen, die die weitere Entwicklung der Leitsubstanzen unterstützen. Die Enthalpie- und Entropiebeiträge zur Bindungsenergie geben Aufschluss über die Art der Wechselwirkung zwischen dem potenziellen Wirkstoff und dem Target. Diese Informationen können zur Aufstellung von Struktur-Wirkungs-Beziehungen und zur Unterstützung des computergestützten Wirkstoffdesigns herangezogen werden.
Obwohl die ITC diese wertvollen und detaillierten Informationen mit einem einzigen Experiment liefert, war das Verfahren in der Arzneimittelforschung nicht allgemein verbreitet. Grund ist der bei herkömmlicher Methodik anfallende erhebliche Protein- und Substanzverbrauch. Diesem Problem wurde durch die Markteinführung des MicroCal iTC200 begegnet. Im Vergleich zu älteren ITC-Systemen weist er einen auf ein Siebtel reduzierten Probenverbrauch und einen um zwei- bis viermal schnellere Stabilisierung auf, entsprechend einer Erhöhung des Durchsatzes.
Alle Proteine, Peptide und niedermolekularen Substanzen wurden bei Hoffmann-La Roche im eigenen Haus hergestellt. Das MicroCal iTC200 wird von Malvern Instruments angeboten. Alle Experimente wurden bei 25 °C durchgeführt.
Alle Puffer wurden vor der Verwendung entgast. Die Probenzelle wurde mit Bcl-2 (30 µM Lösung) in 50 mM HEPES (pH 7,4), 100 mM NaCl, 0,5 mM TCEP und 5 % DMSO befüllt. Die Peptide wurden im gleichen Puffer auf eine Konzentration von 250 µM verdünnt. Das Injektionsvolumen betrug jeweils 3 µl, die Injektionszeit 6 s und die Verzögerungszeit zwischen den einzelnen Injektionen 150 s. Die Daten wurden mit der MicroCal-kompatiblen Software Origin™ (OriginLabs) analysiert.
|
Zur Bewertung der Qualität von Proteinpräparaten wurden ITC-Daten verwendet, insbesondere Stöchiometrie (n) und Affinitätskonstante (KD).
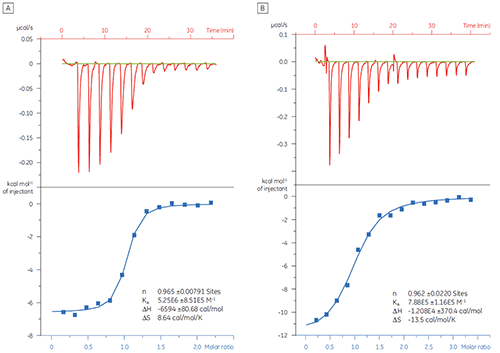
In diesem Beispiel wurde mit dem MicroCal iTC200 die Wechselwirkung zweier unterschiedlicher Peptide mit dem Zielprotein Bcl-2 untersucht (Name abgeleitet von „B cell lymphoma 2“). Die Ergebnisse sind in Abbildung 1 gezeigt. Die Bindungsaffinität des BAD-ähnlichen Peptids (BAD: Bcl-2-Associated Death promoter) für Bcl-2-Protein ist ca. sechsmal stärker als die des BAX-Peptids (BAX: Bcl-2-Associated X protein).
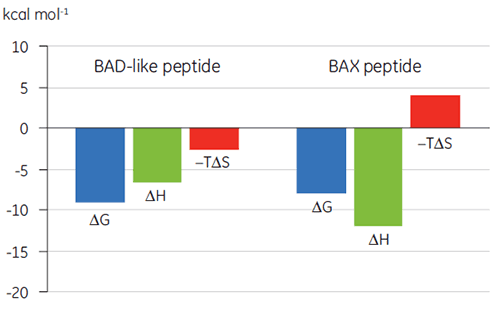
Durch die Visualisierung der thermodynamischen Parameter in der Form eines Bindungssignatur-Diagramms (Abb. 2) ist es einfacher, zu erkennen, wie die Enthalpie- und Entropiekomponenten zur Gesamtaffinität beitragen (hier als ΔG dargestellt). Diese Diagramme zeigen auf, dass die Bindung des BAD-ähnlichen Peptids an Bcl-2 auf polaren und hydrophoben Wechselwirkungen basiert. Dies wird durch die negative oder günstige Bindungsenthalpie (ΔH) und den Entropiefaktor (TΔS) belegt. Die Bindung von BAX umfasst stärkere konformationelle Änderungen, wie durch die ungünstige Entropie belegt.
|
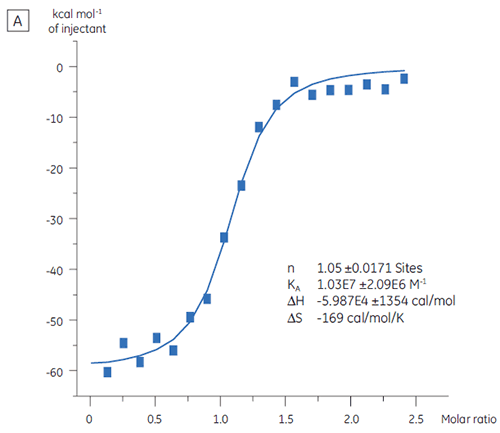
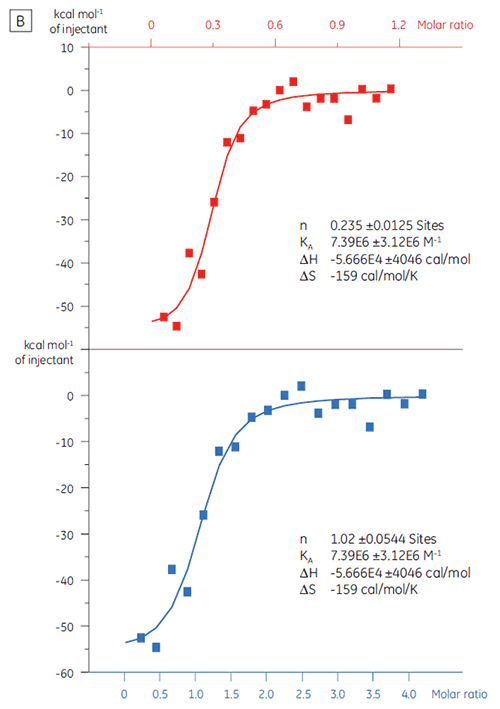
Die ITC kann zur Bewertung der Bindungsaktivität des Zielproteins eingesetzt werden, bevor dieses in eine Screening-Kampagne aufgenommen wird. In dieser Untersuchung wurden zwei Chargen eines Zielproteins durch Titration mit einem positiven Kontrollpeptid verglichen, das sich mit einer Affinität von 97 nM an das Zielprotein bindet (Abb. 3).
|
|
Die Ergebnisse für die erste Charge, Charge A (Abb. 3 A), zeigen eine erwartete Isotherme mit KD = 97 nM und n = 1. Dies weist auf ein vollständig aktives Protein hin. Die zweite Charge, Charge B (Abb. 3 B), hat einen KD-Wert von 135 nM. Der n-Wert beträgt jedoch nur 0,23, was auf ein Protein hinweist, das nur teilweise aktiv ist. Die Analyse desselben Datenbestands, jedoch mit einer Proteinkonzentration von 2,3 µM statt 10 µM, ergibt denselben KD-Wert und n = 1. Dies deutet darauf hin, dass 75 % des Charge-B-Proteins inaktiv waren. Das Charge-B-Protein wurde aus der
Screening-Kampagne ausgeschlossen.
Bei Screening-Kampagnen müssen Falsch-Positive möglichst frühzeitig ausgeschlossen werden. Eine 20 µM Lösung des Zielproteins (TP) wurde mit Substanz X titriert (Abb. 4). Der KD-Wert (definiert als 1/KA) wurde mit 4,9 µM bestimmt. Dieser Wert korreliert gut mit Untersuchungen, die mittels SPR und NMR durchgeführt wurden. Somit wird bestätigt, dass Substanz X ein echter, für weitere Untersuchungen geeigneter Hit ist.
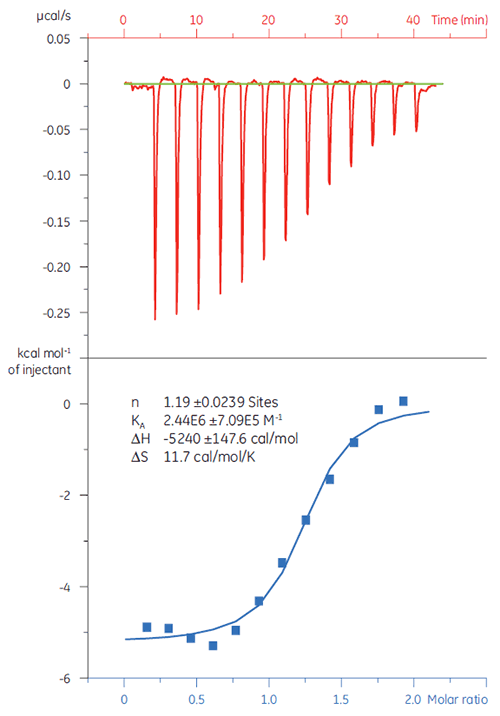
|
Wenn dasselbe Zielprotein mit Substanz Y titriert wurde, waren die Ergebnisse sehr unterschiedlich (Abb. 5). In Bildteil A ist die Titration von Substanz Y mit TP dargestellt. Die Isotherme zeigt eine apparente Bindungsaffinität von 120 nM. Die Bindungsenthalpie war jedoch um das 1000-fache höher als erwartet, und der Stöchiometriewert war sehr niedrig (n = 0,01). In Bildteil A ist die Titration desselben Wirkstoffkandidaten mit Rinderserumalbumin (BSA) dargestellt. Insgesamt gesehen weisen die Ergebnisse auf eine nichtspezifische Aktivität hin. Basierend auf diesen Experimenten wurde Substanz Y als falsch positiv erachtet und von weiteren Untersuchungen ausgeschlossen.
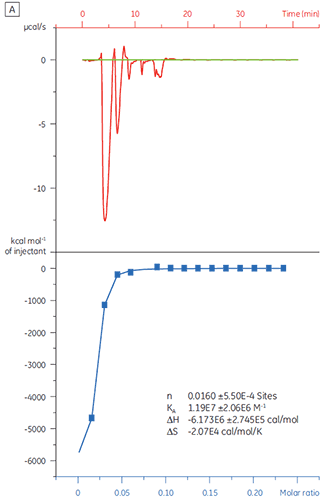
|
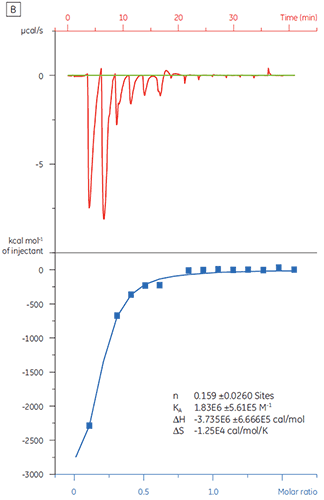
|
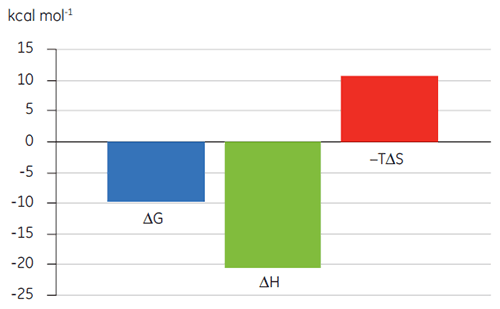
Vorangegangene Untersuchungen der Bindung von Substanz A an TP zeigten einen KD-Wert von 25 nM. Um die Thermodynamik dieser Wechselwirkung näher zu charakterisieren, wurde ein ITC-Experiment durchgeführt (Abb. 6). Eine 100 µM Lösung von Substanz A wurde in eine 10 µM Lösung von TP titriert. Der KD-Wert betrug 65 nM. Die Bindungssignatur (Abb. 7) zeigt, dass die Affinität stark durch enthalpische Wechselwirkungen bestimmt wird, entropisch jedoch gegenläufig ist.
Enthalpische Wechselwirkungen werden typischerweise durch Wasserstoffbindungen und Van-der-Waals-Wechselwirkungen bestimmt. Eine günstige entropische Bindungsaffinität leitet sich jedoch aus hydrophoben Wechselwirkungen ab. Eine ungünstige Entropie, wie in diesem Beispiel, resultiert aus einer allgemeinen Abnahme der Freiheitsgrade der interagierenden Spezies, relativ zum Komplex. Das ist stets der Fall, wenn zwei Moleküle miteinander interagieren. Die Größenordnung des Effekts lässt jedoch vermuten, dass das Protein eine konformationelle Änderung erfahren hat oder dass der Ligand sehr flexibel ist. Die Verringerung dieser ungünstigen Entropie gibt einen definierten Optimierungspfad vor, der mittels ITC verfolgt werden kann.
Es wurde bereits früher gezeigt, dass es schwieriger ist, die Enthalpie zu optimieren als die Bindungsentropie. Wird bei der Optimierung der Affinität nur einer dieser Parameter priorisiert, wies die resultierende Substanz u. U. ungünstige pharmakokinetische Eigenschaften auf (zu hydrophil oder zu hydrophob). Insgesamt gesehen ist es besser, mit einer Leitsubstanz zu beginnen, die enthalpisch bestimmt ist, und dann die verbesserte Entropie „einzudesignen“.
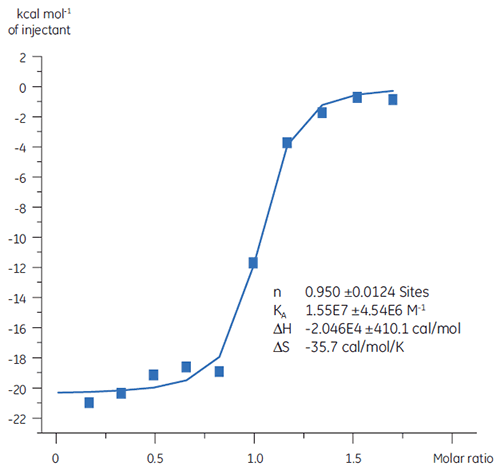
|
|
Das MicroCal iTC200 ermöglicht die Integration des ITC-Verfahrens in den Workflow der Wirkstoffforschung:
Die Daten wurden freundlicherweise zur Verfügung gestellt von Dr. Lin Gao, Hoffman-La Roche, Nutley, NJ, USA.