Normalerweise wird der Titer von Bakteriophagen- und Viruspartikeln durch einen Plaque-Assay oder, im Fall von Viren in tierischen Zellen, durch einen zellbasierten Bioassay nachgewiesen. In diesen Anordnungssystemen werden infektiöse Viruspartikel in konfluenten Zellrasen gezüchtet, um Plaques (Zonen zerstörter Zellen) zu bilden, die gezählt werden können, um die Anzahl der Plaque bildenden Einheiten (plaque forming units; pfu) zu bestimmen. Zwar ist dadurch eine direkte Zählung einzelner infektiöser Viruspartikel möglich, doch nicht infektiöse Viruspartikel bilden keine Plaques. Aggregate, die viele Viruspartikel enthalten, bilden nur einzelne Plaques. In vielen Fällen müssen Hersteller allerdings die Anzahl der Viruspartikel in einem Präparat ungeachtet ihrer Infektiosität bestimmen und das Ausmaß der Aggregation des Präparats, sofern vorhanden, als frühzeitiges Anzeichen einer begrenzten Haltbarkeit ermitteln.
Mit der Nanoparticle Tracking Analysis (NTA) ist es möglich, Partikel im Nanometerbereich, beispielsweise Viren und Virusaggregate, in Flüssigkeiten direkt und individuell in Echtzeit darzustellen, wodurch hochauflösende Profile der Partikelgrößenverteilung erhalten werden. Schnell, robust, präzise und kostengünstig stellt die Technik eine attraktive Ergänzung zu bestehenden Verfahren zur Nanopartikelanalyse wie dynamische Lichtstreuung (DLS), Photonenkorrelationsspektroskopie (PCS) oder Elektronenmikroskopie (EM) dar.
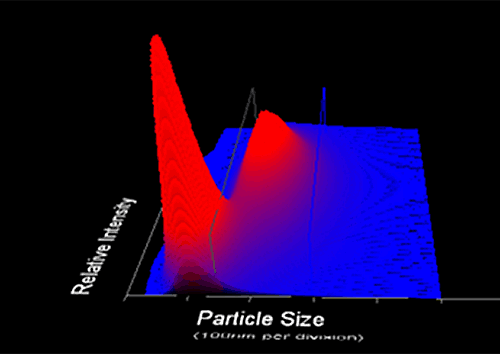
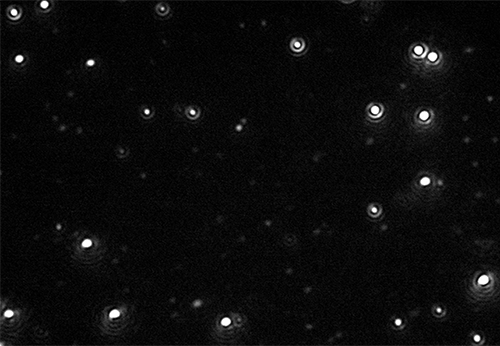
Die NanoSight Produktreihe von Malvern Instruments nutzt die NTA zur Analyse von Partikeln mit einem Durchmesser von 10 nm bis 2000 nm in Flüssigkeiten. Bei der NTA werden die Eigenschaften der Lichtstreuung und der Brownschen Bewegung genutzt, um die Größenverteilung von Partikeln in flüssigen Suspensionen zu ermitteln. Ein Laserstrahl wird durch die Probenkammer gelenkt, und die Lichtstreuung durch die Partikel in der Suspension, die auf dem Weg dieses Strahls liegen, ermöglicht eine einfache Visualisierung. Anschließend wird mithilfe der Stokes-Einstein-Gleichung die Größe der einzelnen Partikel berechnet. Die Ergebnisse werden als Graphen dargestellt, in denen die Größe der Anzahl der einzelnen Partikel (oder der relativen Helligkeit) gegenüber gestellt wird.
|
Bei viralen Impfstoffpräparaten ist ein Nachweis (Validierung) der Stabilität sowie des Anteils der aktiven Elemente erforderlich. Die NTA ermöglicht eine unmittelbare und direkte Schätzung der Produktreinheit und -konzentration. Auf ähnliche Weise können mittels NTA das Ausmaß und die Rate der Bildung von Aggregaten in einem Viruspräparat gemessen werden, sodass der Hersteller verbesserte Fertigungsprozesse für seine Produkte entwickeln und deren Haltbarkeit optimieren kann.
Da die NTA die Visualisierung und Größenmessung aller Partikel in einem Präparat gestattet, stehen zusätzliche Informationen über den Nanopartikelgehalt schneller zur Verfügung als dies mit konventionellen TCID50- oder Plaque-Assays möglich wäre. Wenn größere Partikel (deren Größenbestimmung und Zählung mittels NTA erfolgen kann) vorhanden sind, könnte es sich beispielsweise um nicht virale Zellreste aus dem Zellkulturprozess oder Aggregate von Viruspartikeln handeln, die viele einzelne Virionen enthalten.
Beide dieser Aggregate/Fremdstoffe stellen mögliche Probleme für den Hersteller dar, können jedoch mit einem NanoSight System von Malvern sofort erkannt werden.
|
Die Effektivität der Virusbeseitigung wird getestet, indem Proben mit einem Aliquot einer hochkonzentrierten Virusprobe (verschiedenen Typs ja nach Anwendung) versetzt werden. Diese werden dann zur Prüfung von Prozessschritten eingesetzt, die als Sicherheitsschritte qualifiziert werden müssen. Die Daten müssen mit reinem, nicht aggregierten Virus-Spike-Material gewonnen werden, das mit einem hohen Titer vorbereitet und vor dem Einsatz gelagert werden muss. Die NTA eignet sich optimal für das Feststellen des Aggregationsstatus vor und nach der Lagerung.
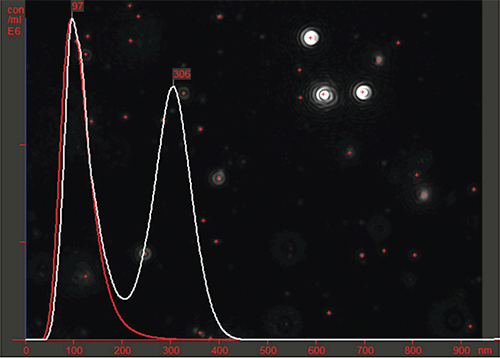
Mit der NanoSight Gerätereihe von Malvern ist es möglich, den Gehalt von Fremdstoffen und Aggregaten in einem Viruspräparat schnell zu erkennen und zu quantifizieren. Zur Optimierung von Aufreinigungsprotokollen für Virenpräparate durch Prozessentwickler ist diese Funktionalität äußerst hilfreich. Abbildung 3 zeigt beispielsweise den Unterschied zwischen einem teilweise gereinigten Viruspräparat (weiße Linie) und derselben Probe nach dem erfolgreichen Anwenden eines effizienten Aufreinigungsprotokolls, mit dem das gesamte Fremdstoff- oder Aggregationsmaterial effektiv entfernt wurde (rote Linie). Die vertikale Achse stellt die Partikelkonzentration (Viruspartikel pro ml) dar.
|
Viruspartikelnachweis und -zählung mittels NTA liefern wesentliche Informationen für die Forscher am Institute of Pharmacy and Biomedical Sciences (IPBS) der Universität von Strathclyde in Großbritannien. Dort werden Verfahren für den Einsatz natürlich vorkommender Bakterien zur Bekämpfung von MRSA entwickelt. MRSA (oder Methicillin-resistenter Staphylococcus aureus) ist eine Variante des Bakteriums Staphylococcus aureus, das eine Resistenz gegen die meisten Antibiotika entwickelt hat, sodass es schwer behandelbar und potenziell tödlich ist. Während der „Supererreger“ mit Detergenzien getötet werden kann, ist die Verdünnung und Aufbringung von Detergenzien oft inkonsistent und ineffektiv, sodass die Bakteriophagentherapie eine attraktive Alternative darstellt. Bei der Bakteriophagentherapie werden Bakteriophagen eingesetzt, um das Wirtsbakterium durch eine Replikation in seinem Inneren und eine darauffolgende Lyse der Wirtszellen zu zerstören.
Ein Team von geführt von Dr. Mike Mattey, Ehrenprofessor beim IPBS. beschäftigt sich mit der Charakterisierung von Bakteriophagen Kulturen mittels die NTA . Bevor Bakteriophagen als eine Trockenbeschichtung für den Schutz von Stellen mit hohem Risiko für eine Bakterieninvasion (Nähte, Geräte und Wunden) zur Verfügung gestellt werden können, müssen die Kulturen charakterisiert und ihre Konzentration beurteilt werden. Die NTA macht es dem Forschungsteam möglich, die Virenkulturen schnell und kostengünstig in Echtzeit zu beobachten und deren Größe zu bestimmen. „Für die Charakterisierung von Viruspopulationen müssen Aggregationen im Größenbereich von 20 nm bis 1000 nm untersucht werden“, sagt Dr. Mattey. Nanosight bietet eine schnelle und einfache quantitative Probencharakterisierung Darüber hinaus bietet die Technologie von Nanosight eine zusätzlichen Blick auf die Partikelpopulation, der die Ergebnisses der Zählung unterstützt.
Bis heute wurden zahlreiche Virustypen erfolgreich analysiert. Einige Beispiele sind:
(Carr, B. (2009) Nanopartikel Tracking-Analyse: direkte Visualisierung zur Zählung und Charakterisierung von Viruspartikeln in Flüssigkeiten. Die Herausforderung der virale Pandemien, 2009 - Biotech-online.com)