In dieser Application Note zeigen wir, wie mit Geräten der NanoSight Linie eine Nanopartikel-Tracking-Analyse (NTA) durchgeführt wird, um den Zustand von Nanopartikeln zu bestimmen, insbesondere deren Größe, Größenverteilung und Konzentration in Testmedien, bevor nanotoxikologische und ökotoxikologische Untersuchungen folgen.
Die rasche Zunahme der Entwicklung und des Einsatzes technischer Nanopartikel (NP) eilt den Methoden für die Beurteilung und das Management ihrer potenziellen Risiken nach wie vor voraus. Neuartige Eigenschaften, die aus der Partikelgröße im Nanobereich resultieren, bilden die Grundlage für das Leistungsversprechen von Nanomaterialien. Selbst wenn die Toxikologie, des Produktes in grober Form, gut bekannt ist, kann keinesfalls automatisch von einer Analogie der Eigenschaften für dasselbe Material im Nanomaßstab ausgegangen werden. Es handelt sich vielmehr um grundsätzlich neue Materialien. Es wächst das Bewusstsein, dass die längerfristigen potenziellen toxischen Auswirkungen solcher Materialien und deren mögliche Umweltauswirkungen noch nicht ausreichend erforscht sind. Demzufolge gilt den potenziellen toxikologischen Auswirkungen technischer Nanomaterialien ein starkes Interesse und intensive Forschungstätigkeit. Begleitet wird dies von einer Bewertung der Bedeutung der Nanopartikelfraktionen in bestehenden Produkten und Formulierungen.
Vor Beginn einer nanotoxikologischen Untersuchung ist es unerlässlich, den Zustand der verwendeten Nanopartikel zu kennen. Dies betrifft insbesondere deren Größe, Größenverteilung und Konzentration in einem geeigneten Testmedium.
Die Partikelgröße bestimmt die Diffusionsraten, die Durchdringung oder Schutzwirkung von biologischen Barrieren und die Partikelwechselwirkungen.
In dieser Application Note wird die Anwendung der Nanopartikel-Tracking-Analyse (NTA) zur Charakterisierung von Gold-Nanopartikeln und deren Aggregaten in einer biologisch relevanten Flüssigkeit erörtert. Ergänzend zu den klassischen Lichtstreuungsverfahren ermöglicht die NTA die Größenbestimmung und Zählung von Nanopartikeln in Suspension auf einer partikelspezifischen Basis und damit eine hoch aufgelöste Charakterisierung der Aggregation. Die Studie untersucht die Größenänderung von Gold-Nanopartikeln. Dabei wird die Standarddispergierlösung (Citratpufferlösung) mit einem verdünnten Plasma verglichen (das Proteine enthält) (NIST, 2007).
Von gesunden Spendern wurden Blutproben genommen. Die Probenröhrchen wurden 5 Minuten lang bei einer RZB von 800 zentrifugiert, um die roten und weißen Blutkörperchen abzusetzen. Die überstehende Flüssigkeit (das Plasma) wurde in beschriftete Probenröhrchen umgefüllt und bei -80 °C aufbewahrt. Nach dem Auftauen wurde das Plasma erneut 3 Minuten lang bei einer RZB von 16100 zentrifugiert, um die Restanteile von roten und weißen Blutkörperchen weiter zu verringern. Die überstehende Flüssigkeit wurde in ein neues Gefäß umgefüllt, wobei darauf geachtet wurde, den Bodensatz nicht aufzuschütteln.
Es wurden Gold-Nanopartikel nach NIST-Standard mit einem Durchmesser von 60 nm verwendet (NIST-Referenzmaterial 8013). Diese wurden gemäß den relevanten Untersuchungsberichten gelagert, vorbereitet und verwendet (NIST, 2007). Das Gold wurde unter Verwendung einer Standard-Citratpufferlösung mit einem pH-Wert von 7,19 auf eine Konzentration von ca. 108 Partikeln/ml verdünnt. Für die Dispersionen in Plasma wurde das Humanplasma im Verhältnis 1:106 mit Citratpufferlösung verdünnt. Anschließend wurden 10 µl der Gold-Nanopartikel mit 790 µl des verdünnten Plasmas verdünnt.
Die Nanopartikel-Tracking-Analyse wurde auf einem NanoSight LM10 durchgeführt. Alle Probenvorbereitungen und Messungen wurden an der University College Dublin in Irland durchgeführt. Es wurden mehrere Videos mit einer Länge von je 166 s aufgezeichnet und im Chargenmodus analysiert, um eine statistische Invarianz zu gewährleisten. Da es sich bei Plasma um ein natürliches ionisches Medium handelt, ist anzumerken, dass das Problem der Proteinaggregation stets vorhanden ist.
Es wurden Videos von den Nanopartikeln aufgezeichnet (Abbildung 1), nachverfolgt und auf Größe und Konzentration analysiert. Dabei wurden Verdünnungen in Citratpufferlösung und Humanplasma untersucht.(Abbildung 2).
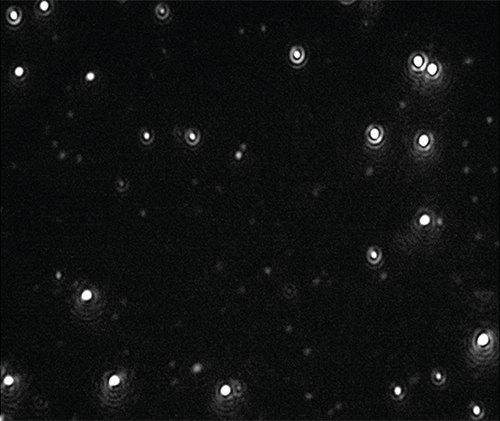
|
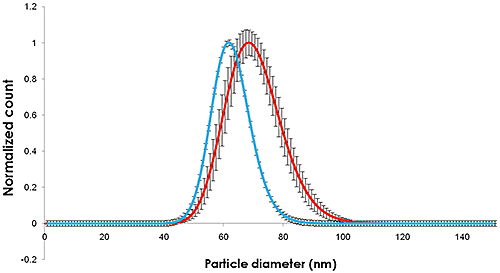
|
Die Methoden für die Messung von in Citratpufferlösung verdünntem Gold entsprachen denen im Referenzmaterialbericht (NIST, 2007).
Mit der NTA kann sowohl anhand einer visuellen Identifizierung als auch anhand einer Konzentrationsmessung festgestellt werden, dass die Partikel weiterhin monodispergiert sind. Dies stützt die Hypothese, dass Proteine in Suspension die Nanopartikel umhüllen (und dass die Größenzunahme nicht auf Aggregation zurückzuführen ist).
Die in den Abbildungen 1 und 2 verzeichneten Größenänderungen zeigen eine Zunahme der Nanopartikelgröße von ca. 10 nm, entsprechend einer 5 nm dicken adsorbierten Proteinschicht, die die Nanopartikel umhüllt.
In Gegenwart eines biologischen Mediums wie Humanplasma wurde eine signifikante und messbare Änderung der Partikelgrößenverteilung von monodispersen Gold-Nanopartikeln festgestellt. Es wird eine geeignete Methode zur Messung der Dicke der Plasmaschicht mittels Nanopartikel-Tracking-Analyse beschrieben.
Breite und Mittelwert der Verteilung der in Citrat dispergierten und mittels NTA gemessenen Partikel sind vergleichbar mit den am NIST bestimmten Werten. In Gegenwart von Plasma nehmen sowohl die Partikelgröße als auch die Partikelgrößenverteilung zu.
Die NTA ermöglicht die Messung der absoluten Konzentration, wodurch sie auch zur Bestimmung der Anzahlkonzentration der NIST-Gold-Nanopartikel eingesetzt werden kann. Zudem eignet sich die NTA ideal zur Identifizierung und Zählung von Nanopartikelaggregaten, wie z. B. von Dimeren, die damit leicht unterschieden werden können. Sie stellt somit (für die hier verwendeten Nanopartikel und Konzentrationsregimes) innerhalb des bestehenden Spektrums an Techniken für die Bionanoforschung und die Untersuchung der Bionanointeraktionen von technischen Nanomaterialien in der Biologie ein nützliches Instrument dar.
Die NTA ist als analytische Methode anerkannt, um Informationen über die Größe und – gleichermaßen wichtig – die Konzentration von Nanopartikeln zu gewinnen. Dies gilt selbst für komplexe Probentypen mit hoher Polydispersität (Montes-Burgos et al., 2010; Lynch, 2008; Montes-Burgos et al., 2007). Die NTA gehört zu einer Reihe von Verfahren, mit denen die Umweltauswirkungen und die potenzielle Zytotoxizität von Nanopartikeln in Zukunft untersucht werden könnten (Borm et al., 2006; Tenuta, 2008; Tran, Anton, 2009; Kuhlbusch et al., 2010; Hassellöv, Kaegi, 2009; Stolpe et al., 2011).
Neuere Studien haben gezeigt, dass die Wechselwirkungen zwischen NP und Umweltmatrices extrem komplex sind und hinsichtlich ihrer Quantifizierung und Modellierung eine beträchtliche Herausforderung darstellen. Gerade hier kann die NTA jedoch einen Weg zur Untersuchung und Analyse bereitstellen (Gornati et al., 2009; Hartmann, 2011; Arvidsson et al., 2011; Howard, 2010; Njuguna et al., 2011; Tran et al., 2009).
In einer Studie über die Auswirkungen einer Beschichtung auf nullwertigem Nanoeisen (nZVI) auf die frühe Entwicklung von drei wichtigen marinen Wirbellosen haben Kadar et al. (2012) mittels NTA die Auflösung von nZVI in Meerwasser untersucht und gezeigt, dass die Beschichtung zur Stabilisierung der Nanometallsuspension beitrug. Des Weiteren hat Kadar die Auswirkungen von industriell relevanten und mittels NTA analysierten technischen Eisennanopartikeln auf das Wachstum und den Stoffwechselstatus von marinen Mikroalgenkulturen untersucht. Dabei beschrieb er nachfolgende Veränderungen der Wachstumsrate, Größenverteilung, Lipidprofile und zellulären Ultrastruktur (Kadar et al., 2012).
Poynton et al. (2012) verwendeten ein 15-k-Oligonukleotid-Microarray für Daphnia magna, einen Süßwasserkrebs, der als gängige Indikatorart für Toxizität dient, um zwischen partikelspezifischer Toxizität und der Toxizität von Silberionen zu unterscheiden und Expositionsbiomarker für Citrat beschichtete und PVP-beschichtete Silber-NP zu entwickeln. Dabei bestimmten sie den Grad der Aggregation von Silber-NP mittels NTA, bevor sie deren Toxizität auf dem Genomniveau untersuchten.
Bei einer Untersuchung der Toxizität von Zinkoxid-Nanopartikeln gegenüber Folsomia Candida haben Waalewijn-Kool et al. (2012) gezeigt, dass Unterschiede in den Methoden zur Aufstockung von Expositionsmedien zum Testen von Dispersionsgrößeneigenschaften kaum Änderungen der Reproduktionskapazität des Organismus zur Folge hatten. NTA und TEM zeigten übereinstimmend, dass die Toxizität von Zinkoxid nicht in Zusammenhang mit der Partikelgröße steht.
Auf zellulärer Ebene hat sich die NTA bei der Untersuchung der Genotoxizität von Cobalt-NP in peripheren humanen Leukozyten (Colognato et al., 2008) und Mausfibroblasten (Ponti et al., 2009) als nützlich erwiesen. Die Fähigkeit von Nanopartikeln, die menschliche Plazentaschranke zu durchdringen (Wick et al., 2009), sowie Methoden zur Untersuchung ihrer Wirkungen auf andere biologische Barrieren wurden erforscht (Linn et al., 2010). Hierzu gehört auch der Transport von Siliciumdioxid-Nanopartikeln durch die menschliche Haut (Staroňová et al., 2012). Similarly, Filon et al. (2012) über die Durchdringung der intakten und geschädigten menschlichen Haut durch Cobalt-Nanopartikel. In einem In-vitro-Diffusionssystem konnte Co in Form von Nanopartikeln die menschliche Haut durchdringen.
Ein Verständnis der Größenverteilung von Nanopartikeln ist von entscheidender Bedeutung, bevor sie für zytotoxologische Tests in zelluläre Systeme eingebracht werden. Die NTA hat sich in dieser Hinsicht als nützlich erwiesen (Kendall et al., 2009; Patel et al., 2010; Munaro, 2010; Karlsson, 2010). Die chemischen Interaktionen von Nanopartikeln unterschiedlicher Typen mit diversen Matrices biologischen Ursprungs, wie Serum (Treuel et al., 2010), sowie mit organischen Schadstoffen (Ben-Moshe et al., 2009) und Dithiothreitol (Sauvain et al., 2008) wurden ebenfalls untersucht.
Die toxikologischen Auswirkungen von Cobalt-Nanopartikelaggregaten (Co-NP) wurden untersucht und mit denen von Cobaltionen verglichen. Dabei wurden unterschiedliche Zelllinien verwendet, die Lunge, Leber, Niere, Darm und Immunsystem repräsentierten. Die Gesamtergebnisse waren im Einklang mit der Hypothese, dass die toxischen Wirkungen aggregierter Cobalt-NP hauptsächlich auf das Herauslösen von Cobaltionen aus den aggregierten NP zurückzuführen sind (Limor et al., 2011).
Arvidsson R, Molander S, Sanden BA, Hassellov M (2011) Challenges in Exposure Modeling of Nanoparticles in Aquatic Environments, Human and Ecological Risk Assessment: An International Journal, Band 17, Heft 1, 2011, S. 245-262, DOI: 10.1080/10807039.2011.538639
Ben-Moshe T, Dror I, Berkowitz B (2009) Oxidation of organic pollutants in aqueous solutions by nanosized copper oxide catalysts, Applied Catalysis B: Environmental, Band 85, Hefte 3-4, S. 207-211
Borm P, Klaessig FC, Landry TD, Moudgil B, Pauluhn J, Thomas K, Trottier R and Wood S (2006) Research Strategies for Safety Evaluation of Nanomaterials, Part V: Role of Dissolution in Biological Fate and Effects of Nanoscale Particles, Toxicological Sciences, 90 (1): 23-32
Colognato R, Bonelli A, Ponti J, Farina M, Bergamaschi E, Sabbioni E, Migliore L (2008) Comparative genotoxicity of cobalt nanoparticles and ions on human peripheral leukocytes in vitro, Mutagenesis Advance Access (Online-Veröffentlichung), 25. Mai 2008, und Mutagenesis 2008 23(5):377-382
Filon FL, Crosera M, Timeus E, Adami G, Bovenzi M, Ponti J, Maina G (2012) Human Skin Penetration of Cobalt Nanoparticles Through Intact and Damaged Skin, Toxicology in vitro, http://dx.doi.org/10.1016/j.tiv.2012.09.007,
Gornati R, Papis E, Di Gioacchino M, Sabbioni E, Dalle-Donne I, Milzani A, Bernardini G (2009) In vivo and in vitro Models for Nanotoxicology Testing, Nanotoxicity (eds S. C Sahu, D. A Casciano), John Wiley & Sons, Ltd, Chichester, UK. DOI: 10.1002/9780470747803.ch15
Hartmann NB (2011) Ecotoxicity of engineered nanoparticles to freshwater organisms, Dissertation, April 2011, Department of Environmental Engineering, Technical University of Denmark
Hassellöv M, Kaegi R (2009) Analysis and characterization of Manufactured Nanoparticles in Aquatic Environments. "Nanoscience and Nanotechnology: Environmental and human health implications." (Eds. Lead J.R., Smith E.) Wiley Interscience, Kapitel 6, S. 211-266.
Howard AG (2010) On the challenge of quantifying man-made nanoparticles in the aquatic environment, J. Environmental Monitoring, 12, 135-142. DOI: 10.1039/b913681a
Kadar E, Rooks P, Lakey C, Whitea DA (2012) The effect of engineered iron nanoparticles on growth and metabolic status of marine microalgae cultures, Science of The Total Environment, Band 439, 15. November 2012, S. 8-17
Karlsson HL (2010) The comet assay in nanotoxicology research, Analytical and Bioanalytical Chemistry DOI: 10.1007/s00216-010-3977-0
Kendall M, Ding P, Kendall K and Clark H (2009) Nanotoxicology of PM: Particle interactions with lung surfactant polymers, IEH (2009) Proceedings of the Annual UK Review Meeting on Outdoor and Indoor Air Pollution Research, 20.-21. April 2009 (Web Report W26), Institute of Environment and Health, Cranfield University, UK, verfügbar unter: http://www.cranfield.ac.uk/health/ieh
Kuhlbusch TAJ, Fissan H, Asbach C (2010) Measurement and Detection of Nanoparticles within the Environment. Nanotechnology. S. 229-266
Limor H-A, James KC., Rafi K, Patrice NM, Oded M, Ponti J, Romano R, Rossi F, Golla-Schindler U, Sommer D, Uboldi C, Unger R, Villiers C (2011) Predictive toxicology of cobalt nanoparticles and ions: comparative in vitro study of different cellular models using methods of knowledge discovery from data, Toxicol. Sci. (2011) DOI: 10.1093/toxsci/kfr124 Erstveröffentlichung online: 20. Mai 2011
Linn M, Loretz B, Philippi C, Vajda V (2010) Optical characterization of nanoparticles, 8th International Conference and Workshop on Biological Barriers - in vitro Tools, Nanotoxicology, and Nanomedicine, 21. März-1. April 2010, Universität des Saarlandes, Saarbrücken, Deutschland
Lynch I (2008), NanoInteract - dispersion, cell culture standards, protocols, NanoImpactNet WP1 Workshop, UCD, Irland, 20. Juni 2008.
Montes-Burgos I, Salvati A, Lynch I, Dawson K (2007), Characterization techniques for nanoparticle dispersion, at European Science Foundation (ESF) Research Conference on Probing Interactions between Nanoparticles/Biomaterials and Biological Systems, Sant Feliu de Guíxols, Spanien, 3.-8. November 2007
Montes-Burgos I, Walczyk D, Hole P, Smith J, Lynch I and Dawson K (2010) Characterization of Nanoparticle Size and State Prior to Nanotoxicological Studies, Journal of Nanoparticle Research, Band 12, Nummer 1/Januar, 2010 DOI: 10.1007/s11051-009-9774-z
Munaro B (2010) Mechanistic in vitro tests for genotoxicity and carcinogenicity of heavy metals and their nanoparticles, Dissertation zur Erlangung des akademischen Grades des Doktors der Naturwissenschaften Eingereicht im Fachbereich Biologie an der Universität Konstanz vorgelegt von Barbara Munaro, Juni 2009. Konstanzer Online-Publikations-System (KOPS) URN: http://nbn-resolving.de/urn:nbn:de:bsz:352-opus-121714
National Institute of Standards & Technology, Report of Investigation, Reference Material 8013, Gold Nanoparticles, Nominal 60 nm Diameter 13/12/2007.
Njuguna J, Sachse S, Silva F, Irfan A, Michałowski S, Pielichowski K, Kazmina O, Ermini V, Zhu H, Blázquez M (2011) Investigations into nanoparticles generated from nanofiller reinforced polymer nanocomposites during structural testing, Safety issues of nanomaterials along their life cycle, Symposium am LEITAT Technological Center, Barcelona (Spanien), 4. und 5. Mai 2011.
Patel D, Kell A, Simard B, Xiang B, Lin HY, Tian G (2010) The cell labeling efficacy, cytotoxicity and relaxivity of copper-activated MRI/PET imaging contrast agents, Biomaterials, DOI:10.1016/j.biomaterials.2010.10.013
Ponti J, Sabbioni E, Munaro B, Broggi F, Marmorato P, Franchini F, Colognato R, Rossi F (2009) Genotoxicity and morphological transformation induced by cobalt nanoparticles and cobalt chloride: an in vitro study in Balb/3T3 mouse fibroblasts, Mutagenesis, Juli 2009; DOI:10.1093/mutage/gep027
Poynton HC, Lazorchak JM, Impellitteri CA, Blalock BJ, Rogers K, Allen J, Loguinov AV, Heckman L, Govindasmawy S (2012) Toxicogenomic Responses of Nanotoxicity in Daphnia magna Exposed to Silver Nitrate and Coated Silver Nanoparticles, Environ. Sci. Technol., DOI: 10.1021/es3001618
Sauvain J, Deslarzes S, Riediker M (2008) Nanoparticle reactivity toward dithiothreitol, Nanotoxicology, 2:3, 121-129
Staroňová K, Nielsen JB, Roursgaard MJ, Knudsen LE (2012) Transport of SiO2 Nanoparticles through Human Skin, Basic & Clinical Pharmacology & Toxicology, DOI: 10.1111/j.1742-7843.2012.00873.x
Stolpe B, Lead J, Cole P, Kendall M, Kadar E, Poole J, Whitby C, Colbeck I, Fabrega J and Galloway T (2011) Multimethod characterization of manufactured nanoparticles in toxicity studies, 6th International Conference on the Environmental Effects of Nanoparticles and Nanomaterials, N1.7, The Royal Society, London, 19.-21. September 2011.
Tenuta T (2008) A Systematic Approach to Assessing Potential Environmental Impacts of Nanomaterials: Nanoparticle Synthesis, Characterization and Impact Assessment, EPA Scholarship & Fellowship Seminar - 13. November 2008, Hilton Kilmainham Hotel, Dublin 8, Irland
Tran L, Antón JMN (2009) Nanotoxicology And Engineered Nanoparticle Risk Assessment, Seguridad y Medio Ambiente - Nr. 114, S. 1-45
Treuel L, Malissek M, Gebauer JS, Zellner R (2010) The Influence of Surface Composition of Nanoparticles on their Interactions with Serum Albumin, Chem Phys Chem, Band 11, Heft 14, S. 3093-3099
Waalewijn-Kool PL, Ortiz MD, van Gestel CAM (2012) Effect of different spiking procedures on the distribution and toxicity of ZnO nanoparticles in soil, Ecotoxicology. DOI: 10.1007/s10646-012-0914-3Online First™Open Access
Wick P, Malek A, Manser P, Meili D, Maeder-Althaus X, Diener L, Diener P-A, Zisch A, Krug H F., von Mandach U (2009) Barrier Capacity of Human Placenta for Nanosized Materials, Environmental Health Perspectives DOI: 10.1289/ehp.0901200, (verfügbar unter: http://dx.doi.org/) online 12. November 2009