In dieser Application Note zeigen wir, wie mit Geräten der NanoSight Linie eine Nanopartikel-Tracking-Analyse (NTA) durchgeführt wird, um die Größe und Konzentration von Mikrovesikeln und Exosomen (extrazellulären Vesikeln) bei niedrigen Konzentrationen zu messen. In Verbindung mit Fluoreszenzmarkern kann die NTA zur selektiven Bestimmung und Analyse spezifischer Partikeltypen in einer komplexen Probe eingesetzt werden.
Mikrovesikel und Nanovesikel (Exosomen) finden großes Interesse, da sie zunehmend als potenzielle Biomarker genannt werden. Wenngleich formale Definitionen in diesem zunehmend wichtigen Bereich derzeit noch ausstehen, werden diese beiden Klassen von Bionanopartikeln nach ihren Größenbereichen und ihrer Biogenese unterschieden. Mikrovesikel werden mit typischen Durchmessern zwischen 100 nm und 1 μm beschrieben, Exosomen mit einem Durchmesserbereich von 30 nm–100 nm. Mikrovesikel werden typischerweise durch das sogenannte Blebbing der Plasmamembran gebildet, während Exosomen durch Exozytose aus multivesikulären Körpern des Endosoms freigesetzt werden. Beide scheinen an der zellulären Kommunikation beteiligt zu sein und tragen eine Reihe von Signalproteinen sowie Boten-RNA- und microRNA-Moleküle. Die Blutspiegel sind bei verschiedenen Erkrankungen erhöht. Hierzu gehören Arteriosklerose und koronare Herzerkrankung, hämatologische und inflammatorische Erkrankungen, Diabetes und Krebs.
Bis heute ist die Exosomenforschung aufgrund des Fehlens geeigneter Verfahren zur Charakterisierung eingeschränkt. Die NanoSight Linie von Malvern erfüllt diese Anforderung mit einer einzigartigen und bewährten Technologie. Die Nanopartikel-Tracking-Analyse (NTA) ermöglicht die direkte und individuelle Echtzeit-Visualisierung spezifischer Exosomen und Mikrovesikel in einem Durchmesserbereich von 50 nm–1000 nm in Flüssigsuspensionen. Gleichzeitig liefert die NTA hoch aufgelöste Partikelgrößenverteilungsprofile und Konzentrationsmessungen. Das Verfahren ist einfach anzuwenden, schnell, robust, genau und kosteneffektiv. Damit stellt es eine attraktive Ergänzung zu den bisherigen Verfahren dar. Der Betrieb im Fluoreszenzmodus ermöglicht die Charakterisierung und Differenzierung von geeignet markierten Partikeln unter Verwendung unterschiedlicher Anregungswellenlängen.
Die beiden Verfahren DLS (dynamische Lichtstreuung) und NTA messen die Brownsche Bewegung von Nanopartikeln. Deren Bewegungsgeschwindigkeit oder Diffusionskoeffizient (Dt) steht über die Stokes-Einstein-Gleichung in Beziehung mit der Partikelgröße.
Bei der NTA werden die Partikel in Suspension mit Laserlicht angestrahlt, und das erzeugte Streulicht wird mit einer Videokamera erfasst. Die Partikeldiffusion wird bestimmt, indem die Positionsänderungen eines individuellen Partikels in zwei Dimensionen verfolgt werden. Wenn Dt bekannt ist, kann der hydrodynamische Radius bestimmt werden.
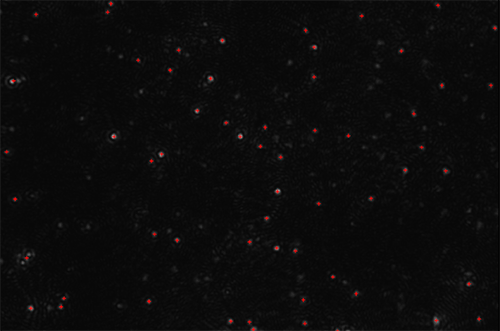
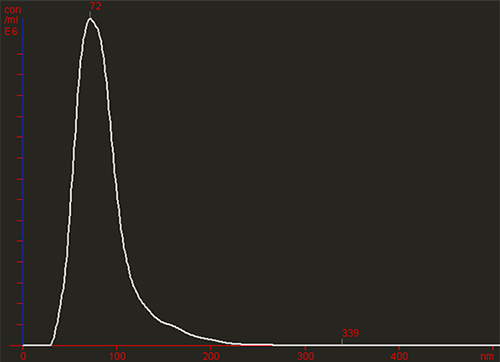
Die folgenden Abbildungen zeigen Partikel in Brownscher Bewegung. Eine erste Sichtprüfung deckt das Vorhandensein größerer Partikel oder aggregierten Materials auf (Abbildung 1A). Die NTA-Software generiert daraufhin in Kürze eine hoch aufgelöste Partikelgrößenverteilung auf der Basis einzelner Partikel sowie eine Zählung (in Form des absoluten Konzentrationswerts) der vorliegenden Vesikel (Abbildung 1B).
|
|
Traditionell wurde eine Reihe von Verfahren verwendet, um Mikro- und Nanovesikel zu charakterisieren. Dabei steht für die Analyse von Mikropartikeln eine größere Anzahl von Verfahren zur Auswahl. Zu diesen gehören:
Von den oben aufgeführten Verfahren wird die Durchflusszytometrie am häufigsten verwendet. Die kommerzielle Durchflusszytometrie weist üblicherweise ein niedrigeres praktisches Größenlimit (für Polystyrolkugeln) von ca. 300 nm auf, ab dem das Signal nicht mehr vom Grundlinienrauschen unterscheidbar ist. Diese Nachweisgrenze kann durch die Verwendung von Fluoreszenzmarkern zwar erweitert werden. Bei geringeren Größen ist jedoch eine genaue Größenbestimmung solcher Partikel nur stark eingeschränkt möglich. In dieser Anwendung wird auch die DLS eingesetzt und liefert genaue Größeninformationen für monodisperse Proben. Die NTA kann zusätzlich zur DLS orthogonale Daten liefern, wenn hoch aufgelöste Größenverteilungen benötigt werden. Die Elektronenmikroskopie ist ein wichtiges Forschungswerkzeug zur Untersuchung von Mikro- und Nanovesikeln. Nachteilig sind jedoch die hohen Betriebskosten, die aufwendige Probenvorbereitung, der geringe Durchsatz und die Beeinträchtigung der Probenintegrität infolge der Probenvorbereitung.
Es ist oftmals ausreichend, zu bestimmen, ob in einer Probe Partikel einer bestimmten Größe oder eines bestimmten Größenbereichs vorhanden sind. Es kann jedoch von Vorteil sein, auch spezifische Subpopulationen von Partikeln in der Probe identifizieren und unterscheiden zu können. Mit dem NanoSight-Verfahren können solche Populationen selektiv analysiert werden. Dabei wird z. B. eine antikörpervermittelte Fluoreszenzmarkierung eingesetzt. Dieser Ansatz ermöglicht den Nachweis und die Analyse ausschließlich derjenigen spezifischen Nanopartikel, an die sich der fluoreszenzmarkierte Antikörper bindet. Das Hintergrundsignal nicht spezifischer Partikel kann durch geeignete optische Filter eliminiert werden. Es können verschiedene Fluorophore eingesetzt werden. Um beste Ergebnisse zu erzielen, ist es jedoch vorteilhaft, Quantum Dots zu verwenden, die eine hohe Effizienz und Stabilität gewährleisten.
Veranschaulicht wird dieses Verfahren in Abbildung 2A, die ein Video-Einzelbild des von Quantum Dots emittierten Fluoreszenzlichts zeigt. Die Anregung erfolgte durch ein NanoSight Gerät mit einer geeigneten blau-violetten Laserdiode (405 nm). Mit diesen Quantenpunkten wurde ein Antikörper markiert (NDOG II). Dieser ist spezifisch für den Zielbiomarker an einem Synzytiotrophoblast-Mikrovesikel (STBM).
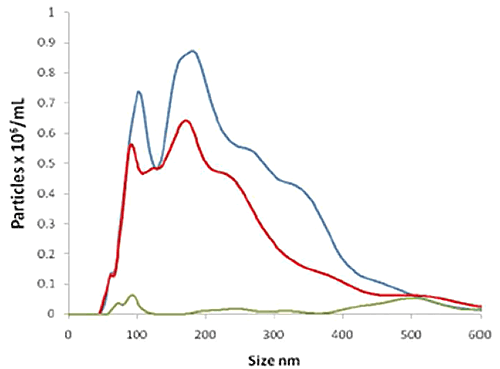
Abbildung 2B zeigt drei Größenverteilungen: i) Alle in der STBM-Probe vorliegenden Partikel (blaue Kurve), nachgewiesen durch (nicht fluoreszente) Lichtstreuung, ii) die Partikel, an die sich der fluoreszente QDot-markierte NDOG-II-Antikörper spezifisch gebunden hat, gemessen im Fluoreszenzmodus (rote Kurve), und iii) eine Kontrolle (grüne Kurve), die aus einem ähnlichen QDot-markierten Antikörper besteht, bei der der Antikörper jedoch keine Affinität zu dem Zielbiomarker am STBM aufweist (auch im Fluoreszenzmodus gemessen). Dies zeigt, dass die Mehrzahl der in der Probe vorliegenden Partikel erfolgreich und spezifisch durch den STBM-spezifischen Q-Dot-NDOG-II-Antikörper markiert wurde, während die Kontrolle erfolgreich ein sehr schwaches Signal liefert.

|
|
Mittels NTA kann die Größenbestimmung und Konzentrationsmessung von Mikrovesikeln und Exosomen bei niedrigen Konzentrationen erfolgen. In Verbindung mit Fluoreszenzmarkern kann die NTA zur selektiven Bestimmung und Analyse spezifischer Partikeltypen in einer komplexen Probe eingesetzt werden.