In dieser Application Note erörtern wir, wie mittels Nanopartikel-Tracking-Analyse (NTA) die Größe und Konzentration von Wirkstoff abgebenden Nanopartikeln wie z. B. Liposomen gemessen werden, um Effizienz und Aufnahmerate sowie Abbau und Ausscheidung aus dem Körper zu bestimmen.
Der Einsatz von Nanopartikeln zur Wirkstoffverabreichung nimmt weiterhin rasch zu. Nanopartikel bieten hervorragende pharmakokinetische Eigenschaften, eine kontrollierte und kontinuierliche Freisetzung und die Ausrichtung auf spezifische Zellen, Gewebe und Organe. Das Interesse an Wirkstoff abgebenden Nanopartikeln beruht auch auf der abnehmenden Rate der Entdeckung neuer biologisch aktiver Verbindungen, die therapeutisch zur Behandlung von Krankheiten genutzt werden können. Während jedes Jahr weniger neue Arzneimittel auf den Markt kommen, nimmt das Interesse am Einsatz der vielseitigen und multifunktionellen Strukturen von Nanopartikeln zur Verabreichung von Wirkstoffen stark zu. All diese Merkmale können die Effizienz bestehender Arzneimittel verbessern (Malam et al., 2011).
Nanopartikel die in der Wirkstoffverabreichung (Drug delivery) eingesetzt werden, wurden als kolloidale Systeme im Submikrometerbereich definiert, die aus verschiednesten Materialien in einer großen Vielzahl von Zusammensetzungen gebildet werden können. Zu den üblicherweise definierten Nanopartikel-Vektoren gehören: Liposome, Mizellen, Dendrimere, feste Lipidnanopartikel, metallische Nanopartikel, Halbleiter-Nanopartikel und polymere Nanopartikel. In ihren verschiedenen Formen wurden Nanopartikel umfassend eingesetzt, um Arzneimittel, Gene, Impfstoffe und Diagnostika in spezifische Zellen oder Gewebe abzugeben (Ram et al., 2011).
Bei der Betrachtung eines Drug-Delivery-Systems aus Nanomaterialien ist die Größe der Nanopartikel ein entscheidender Parameter, da sie einen direkten Einfluss auf die Prozesse der Abgabe, der Aufnahme, des Abbaus und der Ausscheidung aus dem Körper hat. So können z. B. Nanopartikel in einem Durchmesserbereich zwischen 30 nm und ein paar Hundert nm sich aufgrund der pathologisch durchlässigen Gefäße passiv in Tumoren anhäufen, eine Phagozytose findet bevorzugt bei Partikeln größer als 500 nm statt, während die biliäre und renale Ausscheidung bei einer Partikelgröße unter 30 nm bzw. unter 8 nm erfolgt. Des Weiteren zeigt die Leber eine geringere Aufnahme von kleineren Partikeln (25 nm und 50 nm) im Vergleich zu größeren Partikeln (200 nm und 300 nm). Eine genaue Messung der verabreichten Partikel ist daher für viele Systeme und Prozesse unabdingbar.
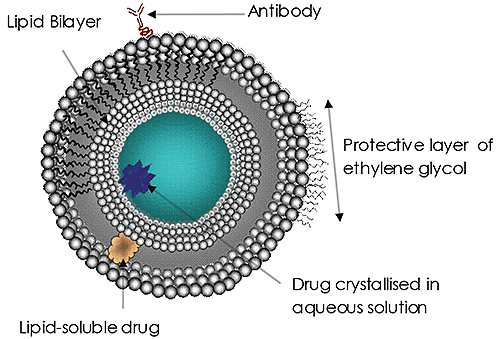
Liposome (Abbildung 1) waren über viele Jahre ein Gegenstand intensiver Forschungs- und Entwicklungsarbeiten und stellen das derzeit am meisten eingesetzte zielgerichtete Drug-Delivery-System dar. Liposome wurden zugelassen als Abgabesystem für Amphotericin B bei Mykosen oder Protozoeninfektionen, für Doxorubicin zur Behandlung von Mammakarzinomen und für Impfstoffe bei Hepatitis A und Influenza. Die Verwendung und das Potenzial von Liposomen zur Wirkstoffverabreichung gewinnen zunehmend an Bedeutung. Die Gründe dafür sind klar:
Die Größe der verwendeten Liposome wird zunehmend als wichtiger Faktor für die Wirksamkeit der Behandlung anerkannt. Die Größe eines Drug-Delivery-Liposoms kann sich auf die Zirkulation und Verweildauer im Blut auswirken, auf die Wirksamkeit der Zielausrichtung, auf die Rate der Zelladsorption (oder Endozytose) und letztendlich auf die erfolgreiche Freisetzung der „Nutzlast“. Solche Größenabwägungen sind bei allen Drug-Delivery-Systemen im Nanomaßstab extrem wichtig.
|
Die Geräte der NanoSight Linie von Malvern können die Größe und Konzentration von Liposomen in Wasser und anderen Lösungsmitteln genau und schnell bestimmen. Es werden nur kleine Volumina benötigt, bei sehr geringer Probenvorbereitung. Die Geräte ermöglichen die Visualisierung individueller Liposome in Suspension und die Verfolgung ihrer brownschen Bewegung. Auf diese Weise können Partikelgrößenverteilungen auf der Basis einzelner Partikel in Sekundenschnelle generiert werden.
|
Neben Größe und Konzentration liefert die NTA auch folgende Parameter, simultan und partikelspezifisch:
Poly-(β-Aminoester) (PBAE) sind potenzielle Drug-Delivery-Systeme für genetische Therapien zur Behandlung verschiedener Tumorarten. Sie haben gegenüber manchen anderen Systemen den Vorteil, dass über den kombinatorischen Weg viele Kombinationen von Polymeren mit DNA erzeugt werden können. Zudem weisen sie infolge hydrolytischen Abbaus eine schnelle Freisetzung auf, wodurch jedoch Dosierung, Produktion und Lagerung erschwert werden. Die Lagerung erfolgt typischerweise durch Gefriertrocknung. Mittels NTA wurde die Auswirkung der Gefriertrocknung auf die Aggregation (Größenzunahme) und Zerstörung (Größenabnahme) der PBAE-DNA-Nanopartikel untersucht (Tzeng et al. 2011 und Sunshine et al. 2012).
Polylactic-co-Glycolid (PLGA) ist ein von der FDA zugelassenes Drug-Delivery-System. Es wird zu Milchsäure und Glycolsäure aufgespalten, die jeweils Endpunkte der Stoffwechselwege im Körper darstellen. PLGA wurde als Drug-Delivery-System für Amoxicillin eingesetzt sowie für ein Gonadotropin freisetzendes Hormon zur Behandlung von fortgeschrittenem Prostatakarzinom. Das Immunsuppressivum Mycophenolsäure wurde in PLGA verkapselt, um die Dosierniveaus zu verringern und somit toxische Nebenwirkungen zu reduzieren. Mittels NTA wurde die Größe dieser Nanopartikel bestimmt – ein entscheidender Parameter, um eine gute Verabreichung zu gewährleisten. Die Forscher konnten damit die Ergebnisse unterschiedlicher Studien vergleichen (Shirali et al. 2011).
Der erfolgreiche Transport von Molekülen durch die Zellmembran ist ein wichtiger Punkt bei der Verabreichung. In vielen Fällen können die Moleküle alleine die Zellmembran nicht durchdringen, sodass eine effiziente Trägersubstanz benötigt wird. Sokolova et al. (2012) haben Calciumphosphat-Nanopartikel (Durchmesser: 100 nm–250 nm, je nach Funktionalisierung) als vielseitige, die Zellmembran durchdringende Träger für kleine und große Moleküle mit eine Reihe von Methoden untersucht, darunter NTA, dynamische Lichtstreuung (DLS) und Elektronenmikroskopie (EM).
Ohlsson et al. (2012) berichteten über einen Stofftransport durch die Lipiddoppelschichtmembran einzelner Proteoliposome in einem Zeitmaßstab von unter 100 ms. Dabei wurden mittels NTA die Stabilität und Integrität der Liposome überprüft.
Bei der Erforschung von Nanopartikeln als Gentransporter berichteten Ghonaim und Mitarbeiter ausführlich über den Einsatz der NTA in ihren Arbeiten zur Auswirkung von Modifikationen der chemischen Struktur von Lipopolyaminen und Sperminen in verschiedenen Drug-Delivery-Systemen auf der Basis nichtviraler Plasmid-DNA und siRNA (Ghonaim et al., 2007a; Ghonaim et al., 2007b; Ghonaim et al., 2007c; Ghonaim, 2008; Ghonaim et al., 2009; Soltan et al., 2009; Ghonaim et al., 2010). In ähnlicher Weise haben Ofek et al. (2010) die NTA zur Charakterisierung von dendritischen Nanoträgern zur siRNA-Verabreichung eingesetzt, während Bhise et al. in ihrer Untersuchung von Gentransferpolymeren in Zellkulturen mittels NTA die Partikelgröße und Größenverteilung gemessen haben (Bhise et al., 2010). Bhise hat diese Arbeit kürzlich erweitert und einen Assay zur Quantifizierung der Anzahl von Plasmiden entwickelt, die in Polymer-Nanopartikeln verkapselt sind. Dabei wurde mittels NTA die Anzahldichte von Plasmiden pro 100 nm Nanopartikel bestimmt (Bhise et al., 2011).
Wei et al. (2012) untersuchten die Herausforderungen und Möglichkeiten einer Weiterentwicklung der Nanomedizin. Dabei erkannten sie die Notwendigkeit für robuste Methoden zur genauen Charakterisierung der Größe, Form und Zusammensetzung von Nanopartikeln sowie für Partikeltechnologien zur Gewährleistung niedriger Werte der unspezifischen Zytotoxizität und zur Verbesserung der Lagerungsstabilität.
Es wurde auch über weitere Beispiele für die Bedeutung der Größenbestimmung und Quantifizierung mittels NTA bei Drug-Delivery-Systemen mit Nanopartikeln berichtet (Hsu et al., 2010; Park et al., 2010; Tagalakis et al., 2010).
1. Bhise NS, Gray RS, Sunshine JC, Htet S, Ewald AJ, Green JJ (2010) The relationship between terminal functionalization and molecular weight of a gene delivery polymer and transfection efficacy in mammary epithelial 2-D cultures and 3-D organotypic cultures, Biomaterials, doi:10.1016/j.biomaterials.2010.07.023
2. Bhise NS, Shmueli RB, Gonzalez J, Green JJ (2011), A Novel Assay for Quantifying the Number of Plasmids Encapsulated by Polymer Nanoparticles. Small. doi: 10.1002/smll.201101718
3. Ghonaim HM, (2008) Design and Development of Pharmaceutical Dosage Forms for Gene and siRNA Delivery, PhD Thesis University of Bath, Department of Pharmacy and Pharmacology, September 2008
4. Ghonaim HM, Li S, Blagbrough IS (2010) N1,N12-Diacyl Spermines: SAR Studies on Non-viral Lipopolyamine Vectors for Plasmid DNA and siRNA Formulation Pharmaceutical Research, Band 27, (1) S. 17-29
5. Ghonaim HM, Li S, Soltan MK, Pourzand C, Blagbrough IS (2007a), Chain Length Modulation in Symmetrical Lipopolyamines and the effect on Nanoparticle Formulations for Gene Delivery, in British Pharmaceutical Conference BPC2007, Manchester, 10. Sept. 2007
6. Ghonaim HM, Li S, Pourzand C, Blagbrough IS (2007b), Efficient Novel Unsymmetrical Lipopolyamine Formulations for Gene Delivery, in British Pharmaceutical Conference BPC2007, Manchester, 10. Sept. 2007
7. Ghonaim H M, Li S, Pourzand C, Blagbrough IS (2007c), Formulation and Delivery of Fluorescent siRNA by Lipospermine Nanoparticle Complex Formation, in British Pharmaceutical Conference BPC2007, Manchester, 10. Sept. 2007
8. Ghonaim H, Li S, Blagbrough IS (2009) Very Long Chain N4 , N9 -Diacyl Spermines: Non-Viral Lipopolyamine Vectors for Efficient Plasmid DNA and siRNA Delivery Pharmaceutical Research, Band 26, Nummer 1, S. 19-31
9. Hsu J, Serrano D, Bhowmick T, Kumar K, Shen Y, Kuo Y C, Garnacho C, Muro S (2010) Enhanced Endothelial Delivery and Biochemical Effects of α-Galactosidase by ICAM-1-Targeted Nanocarriers for Fabry Disease Journal of Controlled Release, Article in Press, doi:10.1016/j.jconrel.2010.10.031
10. Malam Y, Lim E, Seifalian A (2011) Current trends in application of nanoparticles in drug delivery, Current Medicinal Chemistry, Band 18, Nummer 7, März 2011, S. 1067-1078 (12)
11. Ofek P, Fischer W, Calderon M, Haag R and Satchi-Fainaro R (2010) In vivo delivery of small interfering RNA to tumors and their vasculature by novel dendritic nanocarriers. FASEB J..doi 10:1096/fj.09-14964
12. Ohlsson G, Tabaei S, Beech JP, Kvassman J, Johansson U, Kjellbom P, Tegenfeldt JO, Höök F(2012) Solute transport on the sub 100 ms scale across the lipid bilayer membrane of individual proteoliposomes, Lab Chip, 2012, Accepted Manuscript, DOI: 10.1039/C2LC40518K
13. Park J, Gao W, Whiston R, Strom T, Metcalfe S, Fahmy TM (2010) Modulation of CD4+ T Lymphocyte Lineage Outcomes with Targeted, Nanoparticle-Mediated Cytokine Delivery, Mol. Pharmaceutics, 2011, 8 (1), S. 143-152
14. Ram M, Yaduvanshi KS, Yadav H, Singh N, Mangla G, Shivakumar H (2011) Nanoparticles, Promising Carriers in Drug Targeting: A review current drug therapy, Band 6, Nummer 2, Mai 2011, S. 87-96(10)
15. Reshetov et al., Photochem Photobiol. 2012 Sept.-Okt.;88(5):1256-64. doi: 10.1111/j.1751-1097.2012.01176.x
16. Shirali, et al. Am J Transplantation. 2011; 11: 2582-2592
17. Sokolova V, Rotan O, Klesing J, Nalbant P, Buer J, Knuschke T, Westendorf AM, Epple M (2012) Calcium phosphate nanoparticles as versatile carrier for small and large molecules across cell membranes, Journal of Nanoparticle Research, Band 14, Nummer 6 (2012), 910, DOI: 10.1007/s11051-012-0910-9
18. Soltan MK, Ghonaim HM, El Sadek M, Kull MA, El-aziz LA, Blagbrough IS (2009) Design and Synthesis of N4, N9-Disubstituted Spermines for Non-viral siRNA Delivery - Structure-Activity Relationship Studies of siFection Efficiency Versus Toxicity, Pharmaceutical Research, Band 26, Nummer 2, S. 286-295
19. Sunshine et al. PLoS ONE, 2012; 7(5):e37543. doi:10.1371 /journal. Pone .0037543
20. Tagalakis A D, Grosse S M, Meng Q-H, Mustapa M F M, Kwok A, Salehi S E, Tabor A B, Hailes H C, Hart S L (2010) Integrin-targeted nanocomplexes for tumour specific delivery and therapy by systemic administration, Biomaterials, Band 32, Heft 5, Februar 2011, S. 1370-6
21. Tzeng et al. Biomaterials. 2011 August; 32(23): 5402-5410. doi:10.1016/j.biomaterials.2011.04.016
22. Wei A, Mehtala JG, Patri AK (2012) Challenges and opportunities in the advancement of nanomedicines, Journal of Controlled Release, http://dx.doi.org /10.1016/j.jconrel.2012.10.007