Oral inhalierte und nasale Arzneimittelprodukte (OINDPs), die bereits ausgiebig zur lokalen Wirkung eingesetzt werden, sind ebenfalls vielversprechend für die wirksame systemische Verabreichung einer Vielzahl von Therapeutika. Patientenakzeptanz, schnelle Resorption, Vermeidung des Magen-Darm-Trakts und die Möglichkeit zur Produktdifferenzierung sind nur einige der treibenden Faktoren.
Bei der Entwicklung von Inhalatoren oder Sprays gehen die Entwicklung von Formulierung und Gerät Hand in Hand. Änderungen, die für das eine vorgenommen werden, wirken sich auf das andere aus und umgekehrt. So wirken sich beispielsweise Design und Geometrie einer Sprühdüse auf die Stressbelastung der Suspension und damit auf die Tropfenverteilung aus. Ebenso kann sich eine Änderung des Hilfsstoffs auf die Viskosität der Formulierung auswirken und darauf, wie effizient sie durch die Sprühdüse gepumpt werden kann. Dies ist von entscheidender Bedeutung, da die Tröpfchengrößenverteilung Einfluss darauf hat, wo sich das Arzneimittel in den Atemwegen ablagert, und sich somit auch auf seine Bioverfügbarkeit und Wirkungsgeschwindigkeit auswirkt.
Die physikalisch-chemischen Analyselösungen von Malvern Panalytical helfen Ihnen, die Auswirkungen Ihrer Formulierungs- und Verfahrensentscheidungen auf das Arzneimittel-Endprodukt zu verstehen und führen Sie zum Erfolg.
Charakterisierung und Auswahl von Formulierungshilfsstoffen

Bei der Auswahl der Hilfsstoffe gibt es eine Reihe von Überlegungen, die sich auf die Formulierung oder sogar auf das endgültige Arzneimittelprodukt auswirken können. Hilfsstoffe wie Polymere werden häufig verwendet, um die Viskosität einer Suspension oder Lösung zu modulieren. Sie können daher oft die Leichtigkeit des Pumpens oder der Verarbeitung der Suspension beeinflussen, und bei Nasensprays oder Zerstäubern können sie sich direkt auf die Größenverteilung der Tröpfchen des Sprays auswirken. Die Größenverteilung von Wirkstoffträgerpartikeln, wie z. B. Laktose in Trockenpulver-Inhalatoren, ist für die Abgabe des Arzneimittels an die Lunge entscheidend. Außerdem kann die Form von Hilfsstoffen und Wirkstoffpartikeln die Art und Weise beeinflussen, wie sie während der Verarbeitung interagieren und fließen.
Malvern Panalytical verfügt über mehrere Methoden, die üblicherweise für die Analyse von Inhaltsstoffen oder Rohmaterialien verschiedener Lieferanten verwendet werden. Darüber hinaus werden sie zur Bestimmung eingesetzt, um festzustellen, ob verschiedene gleich sind oder Unterschiede aufweisen.
Erfahren Sie mehr über die Charakterisierung von Hilfsstoffen
Pharmaceutical Excipient Characterization
Unsere Lösungen für die Charakterisierung und Auswahl von Hilfsstoffen

OmniSEC
Mastersizer Serie
Morphologi 4-ID
Analyse der Stabilität des aktiven pharmazeutischen Wirkstoffs (API) in der Formulierungs- und Prozessentwicklung

Die Stabilität des aktiven pharmazeutischen Wirkstoffs (API) ist entscheidend für die Bereitstellung einer sicheren und effizienten Dosis des Arzneimittels, und viele Schritte entlang des Entwicklungs- und Fertigungswegs können sich darauf auswirken. Dazu gehören Verarbeitungsschritte, bei denen Bedingungen dazu führen können, dass Hilfsstoffe den API beeinträchtigen. Selbst die Lagerung des fertigen Arzneimittels, bevor es den Patienten erreicht, könnte die Stabilität des API beeinflussen. Daher ist die Charakterisierung des API zusammen mit potenziellen Formulierungshilfsstoffen von entscheidender Bedeutung für ein gutes Verständnis der Stabilität und ihrer möglichen Beeinträchtigung durch Lager- oder Verarbeitungsbeanspruchungen.
Untersuchungen zur beschleunigten Zersetzung des pharmazeutischen Wirkstoffs (API) und der Hilfsstoffe
Die Röntgenpulverdiffraktometrie bietet einen einzigartigen Einblick in die Veränderungen der Kristallform, Kristallitgröße und Morphologie von Arzneimitteln sowie Änderungen des Verhältnisses von amorphen/kristallinen Strukturen in der Formulierung eines pharmazeutischen Wirkstoffs (API) bei beschleunigten Belastungsstudien zur Beurteilung oder Optimierung der Stabilität der Formulierung.
Prozessentwicklung und Prozessüberwachung
Unsere Werkzeuge zur physikalisch-chemischen Charakterisierung werden zur Beurteilung der Stabilität sowohl von APIs als auch von Hilfsstoffen in einer Formulierung unter verschiedenen Verarbeitungsbedingungen eingesetzt, um sicherzustellen, dass die Prozessparameter so kontrolliert und optimiert werden, dass das Endprodukt des Arzneimittels die erforderlichen kritischen Qualitätsmerkmale (Critical Quality Attributes, CQAs) erfüllt.
Sonderartikel
Automatic condensation-free combined temperature-humidity control for XRD studies

XRD Masterclass 2: In situ Stability Studies
Crystallite size determination of a pharmaceutical compound by Rietveld analysis

Crystallinity determination - Quantification of low amounts of amorphous material in a crystalline matrix and vice versa

What are the targeting methods used in solid form analysis?
The influence of electrostatic stabilisation in apolar suspension formulations.

Particle size analysis in pharmaceuticals
Vorgestellte Produkte
Epsilon 1 für die Pharmaindustrie

Morphologi 4-ID
Vergleichbarkeitsstudien – zur Unterstützung von Prozess-, Formulierungs- oder Materialänderungen und In-vitro-Bioäquivalenzuntersuchungen

In jedem Prozess können Änderungen erforderlich sein. In der Pharmaindustrie können beispielsweise Veränderungen beim Lieferanten eines Hilfsstoffs oder API, Veränderungen an einem Maschinenteil, die Verlegung der Herstellung eines Produkts an einen anderen Fertigungsstandort oder eine geringfügige Änderung der Formulierungszusammensetzung auftreten. Alle diese Änderungen müssen kontrolliert werden, damit sie sich nicht auf das fertige Arzneimittel auswirken.
Die physikalisch-chemischen Lösungen von Malvern Panalytical werden im Allgemeinen verwendet, um die Vergleichbarkeitsbewertung zu unterstützen, und um nach Änderungen in einem Produkt zu suchen, wenn es eine Änderung im Prozess gab, mit dem es erstellt wurde. Darüber hinaus werden unsere Technologien auch zum Nachweis der In-vitro-Bioäquivalenz zwischen Referenz- und Testprodukten eingesetzt, wenn Generika entwickelt werden. Mit diesen Tests kann nachgewiesen werden, dass die Kombination aus generischem Produkt und Gerät denselben Wirkstoff auf dieselbe Art und Weise erzeugt wie das innovative Produkt, was den Umfang der erforderlichen klinischen Tests drastisch reduzieren und die Markteinführungeines Generikums beschleunigen kann.
Sonderartikel
Component specific particle sizing in orally inhaled and nasal drug products (OINDPs)
Supporting dry powder inhaler formulation development using component-specific particle characterization
In vitro bioequivalence studies for a metered dose inhaler formulation using the Morphologi automated particle imaging system
Rapid Generic Pharmaceutical Product Development
Achieving Bioequivalence in Generic Formulations by Characterizing Particle Size, Shape & Chemical Identity
Vorgestellte Lösungen

Morphologi 4-ID
Optimierung der Geräte- und Formulierungsleistung
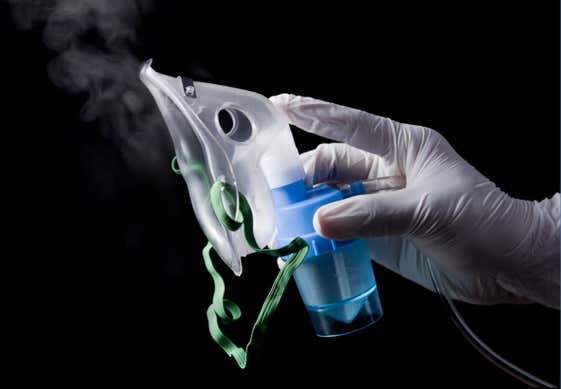
Bei allen oral inhalierten und nasal applizierten Arzneimitteln (OINDPs) ist die vom Gerät abgegebene Spraytröpfchen- oder Partikelgröße ein kritisches Qualitätsmerkmal (Critical Quality Attribute, CQA), das sich direkt auf die klinische Wirksamkeit auswirkt. Die Korrelation zwischen Spraygröße und In-vivo-Abscheidungsverhalten macht die Messung der Partikelgrößenverteilung im Spray für alle inhalierten Produkte während der Entwicklung, Herstellung und Qualitätskontrolle unerlässlich. Darüber hinaus spielen Eigenschaften wie die API-Partikelgröße innerhalb des dispergierten Aerosols ebenfalls eine wichtige Rolle bei der Definition der Wirksamkeit der Arzneimittelverabreichung sowie der allgemeinen Bioverfügbarkeit. Dies ist für die Entwicklung sowohl von innovativen Arzneimitteln als auch von Generika von entschiedender Bedeutung. In Vorformulierungsstudien kann das Verständnis der Merkmale des Referenzarzneimittels oder des Nasensprays selbst von entscheidender Bedeutung sein, um den Einsatz von In-vitro-Bioäquivalenzuntersuchungen zu ermöglichen. Erfahren Sie in den vorgestellten Inhalten mehr über die Charakterisierung und Optimierung von Nasenspray, Verneblern, Trockenpulverinhalatoren und Dosieraerosolen.
Sonderartikel
Inhaler and nebuliser characterization
Laser diffraction and imaging - complementary techniques for nasal spray development
Consistency of Delivery is Key in Nasal Spray Treatments
Enhancing the in vitro assessment of nasal sprays
Vorgestellte Lösungen







