

Die Erfüllung der regulatorischen Anforderungen ist essenziell in der pharmazeutischen Industrie. Die Regularien existieren, damit sichergestellt ist, dass nur sichere und wirksame Produkte, die auf eine genau definierte und nachvollziehbare Weise produziert wurden, den Weg zum Kunden finden. Die Erfüllung dieser Regularien kann jedoch zeitaufwändig und anstrengend sein. Pharmazeutische Unternehmen müssen sich dafür an einem komplexen System von Regularien entlang hangeln. Dies beinhaltet die Anforderungen nach 21 CFR Part 11, Datenintegritätsrichtlinien (ALCOA++) und die USP <1058>, welche den gesamten Prozess für die Qualifizierung von analytischen Geräten aufzeigt.
Regeln für die gute Arbeitspraxis (GxP), wie z.B. die Anforderungen an die gute Herstellungspraxis (GMP/ICH Q7), bilden die Rahmenbedingungen dafür. Ein Gerät wird dabei im Abgleich an die spezifischen Anforderungen des Anwenders (URS = User Requirement Specifications) qualifiziert. Hierbei finden die Prozeduren und Dokumentation für die Qualifizierung der Installation (IQ) und dem Betrieb (OQ) Anwendung. Der Anwender muss dann regelmäßige Tests im Zuge der Performance Qualifikation (PQ) durchführen, um die Leistung des Systems im täglichen Betrieb abzusichern.
Was sind die Herausforderungen um die regulatorischen Anforderungen zu erfüllen?
Analytische Messungen in einem validierten bzw. regulierten Umfeld durchzuführen, benötigt mehr Sorgfalt als jemals zuvor. Zusätzlich zur Erfüllung der Vorgaben nach 21 CFR Part 11 sind die Anforderungen an die Datenintegrität der Messungen (ALCOA++), inklusive der Langzeitarchivierung und der Zugänglichkeit der Daten, sowie die Qualifizierung des Messgerätes selbst, zu betrachten. In manchen Fällen kann die benötigte Zeit, die man für die Begutachtung und Genehmigung der Messdaten benötigt, die Zeit für Messdatenerfassung und -auswertung sogar übersteigen. Dies ist Teil der notwendigen Rahmenbedingungen, die vorhanden sein müssen, um die Entwicklung und Produktion von sicheren Medikamenten zu gewährleisten. Unsere Software, zusammen mit dem OmniTrust-Paket (und der erforderlichen lokalen IT-Infrastruktur) ermöglicht die Erfüllung der 21 CFR Part 11 Anforderungen und der ALCOA++ Datenintegritätsrichtlinie. Die Erfüllung der Regularien wird dann durch regelmäßige Audits von den zuständigen Regulierungsbehörden überwacht.
Wie kann Malvern Panalytical dabei helfen?
Durch viele Jahre Erfahrung in der Qualifizierung von Messinstrumenten und Entwicklung von Software, welche im regulierten Umfeld eingesetzt wird, haben wir einen umfassenden Kenntnisstand auf diesem Gebiet erworben. Neben den Notwendigkeiten, wie umfangreichen IQ/OQ Routinen und Dokumentationen, bieten wir auch folgendes für unsere Produkte an:
- Standards für die Performance Verification (PQ)
- Testabläufe um die 21 CFR Part 11 Funktionen und Datenintegrität auf Ihren Systemen zu validieren.
- Umfangreiche funktionale Software, als Teil Ihrer Lösung um die 21 CFR Part 11 Regularien und Datenintegritätsanforderungen zu erfüllen.
- Beratung und Unterstützung um Ihre Anforderungen an die Validierung oder pharmazeutische Qualifizierung nach GMP/ICH Q7 zu erfüllen oder um zusätzlichen Fragestellungen oder Auflagen gerecht zu werden.
USP <1058>: Qualifizierung analytischer Instrumente
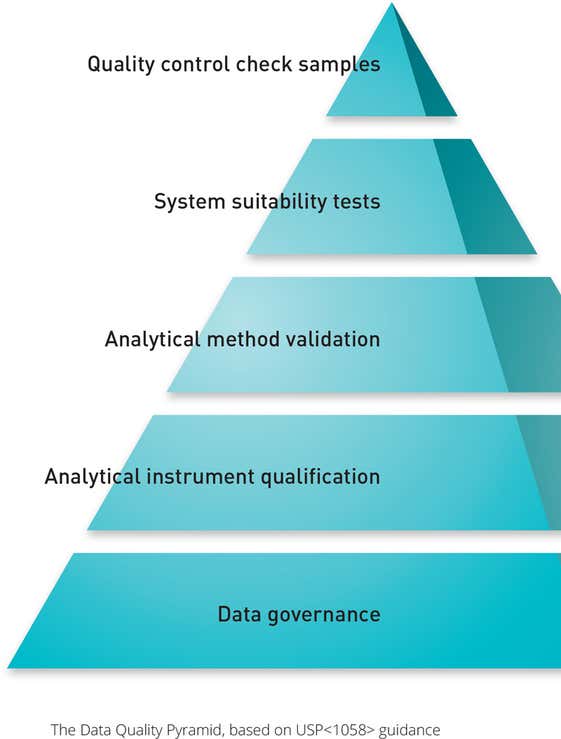
Die in USP <1058> aufgeführten Anforderungen heben die Wichtigkeit der IQ/OQ im Validierungsprozess hervor. Diese Prozeduren sind direkt mit den ursprünglichen Anforderungen des Anwenders für das System (URS) verknüpft, zusammen mit der Performance Qualification (PQ) und Performance Verification (PV).
Die Operation Qualification (OQ) muss nun auch abtesten, dass das System für den Einsatz des Endanwenders geeignet ist und so funktioniert wie der Hersteller es entwickelt hat.
Malvern Panalytical bietet für diesen Zweck ein umfassendes IQ/OQ-Paket an und wir beraten Sie gerne bezüglich zusätzlicher Tests, wenn Sie diese benötigen.
Software für das regulierte Umfeld
Die Auditierung einer Messung kann zeitaufwändig sein. Unsere Software enthält daher viele Funktionen um diesen Vorgang so effizient wie möglich für unsere Kunden zu machen. Sie wurde so entwickelt, dass sie einfach zu bedienen und gleichzeitig leistungsstark ist. Dies spart Zeit bei der Implementierung und der täglichen Benutzung, strukturiert den Arbeitsablauf und gibt Ihnen das vollständige Vertrauen, dass es bei einer Auditierung keine Überraschungen gibt. Die Software bildet zusammen mit einer robusten IT-Infrastruktur die Basis für eine 21 CFR Part 11 konforme Lösung.
Wesentliche Software-Funktionen:
- Definition von Anwendern und Anwendergruppen
- Genehmigungsprozesse für das Signieren von Messergebnissen
- Aufzeichnung von Gründen für den Abbruch einer Messung
- Einträge im Audit Trail für fehlgeschlagene Vorgänge aufgrund von falschen Zugangsdaten
- Auditierung der Sicherheitsfunktionen
 Laden Sie die OmniTrust Broschüre herunter: Die Lösung von Malvern Panalytical für das regulierte Umfeld.
Laden Sie die OmniTrust Broschüre herunter: Die Lösung von Malvern Panalytical für das regulierte Umfeld.
Serviceleistungen für das regulierte Umfeld
Standards
Wir bieten eine Vielzahl von Referenz- und Kalibrierstandards an, um Ihre Validierungsanforderungen zu erfüllen.
IQ/OQ und zusätzliche Testabläufe
Unser Serviceteam führt die IQ/OQ an Ihrem System durch und wir stellen Testabläufe zur Verfügung, um die 21 CFR Part 11 Funktionalität und die Datenintegrität der Software zu validieren.
Validierungsdienstleistungen
Wir haben immer ein offenes Ohr für unsere Kunden bezüglich zusätzlicher Validierungsanforderungen.
Mit unserer Software, insbesondere dem OmniTrust-Paket, stellen wir eine Software für das regulierte Umfeld zur Verfügung, damit Sie von Funktionen zum Aufzeichnen des Audit Trails, elektronischen Unterschriften und unterschiedlichen Zugangsberechtigungen profitieren.
Ausgewählte Inhalte

Demo at your desk – OmniTrust on Mastersizer 3000; Data integrity solution for the regulated environment






