Essa nota de aplicação explora principalmente as aplicações de Calorimetria por titulação isotérmica (ITC) em pesquisa de inibidores de quinase, mas aborda a função da Calorimetria de varredura diferencial (DSC) no processo de descoberta.
A quinoma de um organismo é o conjunto de quinases de proteína em seu genoma, e essas enzimas modificadoras de proteína são possíveis alvos em várias áreas terapêuticas. Os estudos para caracterizar o quinoma humano, juntamente com a explosão de estruturas de cristal de quinase disponíveis nos últimos anos, aumentou o foco em quinases como alvos potenciais para intervenção farmacêutica.
A maioria dos inibidores de quinase que têm sido desenvolvidos desde que a indústria farmacêutica se interessou em quinases no final da década de 1980, tem como alvo o ponto de ligação de ATP da enzima. No entanto, o desenvolvimento do fármaco Gleevec™, um inibidor de tirosina quinase que induz uma reorganização estrutural da quinase BCR-Abl alvo, serviu para revigorar a pesquisa nessa área. Isso gerou ideias inovadoras para abordar a inibição de quinase, inclusive a ligação fora do local do ATP e tentativas de impedir a ativação da quinase.
Os estudos cinéticos de enzima detalhados desempenham um papel integral na caracterização do mecanismo de ação de compostos com base em ideias originais. Uma técnica altamente valiosa é a calorimetria por titulação isotérmica (ITC), que fornece um perfil termodinâmico completo da ligação de um composto à proteína alvo. Os dados produzidos permitem uma comparação das medidas de afinidade para ligação de compostos a diferentes formas de enzima; por exemplo, enzimas livres, complexos enzima-substrato, complexo enzima-produto, enzima ativa e não ativa.
A inibição de cascatas indicadoras de quinase é uma abordagem terapêutica comprovada para o tratamento de doenças nas áreas de oncologia e inflamação. Essa nota de aplicação tem como foco a aplicação de ITC para identificação do complexo intermolecular de quinases que gera atividade biológica, ciente de que a ITC pode fornecer informações quanto à possibilidade de a presença de outro ligante influenciar essa atividade.
A calorimetria por titulação isotérmica mede várias características de uma interação de ligação, inclusive a afinidade (KD), número de pontos de ligação do ligante (n), e a entalpia da reação de ligação (∆H), em um único experimento. A técnica é rápida, não requer identificação fluorescente e pode ser utilizada com proteínas sem atividade catalítica (o que exclui seus estudos de análises cinéticas de enzimas).
Os experimentos de ITC geralmente envolvem a titulação do componente de teste em relação à proteína alvo a uma temperatura constante, com o instrumento de ITC medindo o calor liberado ou absorvido durante o evento de ligação. A técnica pode ser aplicada de várias maneiras durante a descoberta do fármaco focado em quinase da proteína.
Entre elas:
caracterização dos construtos e preparações da proteína, não somente em termos de afinidade correta para ligantes modelo, mas também para a estequiometria correta, permitindo uma estimativa da quantidade de proteína funcional sem a necessidade de atividade catalítica
avaliação de análises
identificação do complexo intermolecular que confere atividade biológica, com a ITC fornecendo informações quanto à possibilidade de a presença de outro ligante influenciar a atividade biológica de um composto de teste, que é o foco desta nota de aplicação.
Antes da realização de estudos mecanicistas, será útil, se não essencial, conduzir uma investigação de controle de qualidade da proteína alvo. Isso pode ser feito por meio da verificação da identidade, pureza, concentração, funcionalidade e estabilidade da proteína.
Os métodos calorimétricos podem ser aplicados em duas dessas áreas importantes. A ITC foi utilizada para validar a funcionalidade de proteínas alvo comparando a afinidade e estequiometria obtidas na titulação de um ligante conhecido com valores da literatura para uma variedade de proteínas alvo. A tecnologia relacionada de calorimetria de varredura diferencial (DSC) foi utilizada para verificar se a proteína apresenta uma temperatura de fusão, Tm, significativamente acima da temperatura do experimento. Geralmente, os domínios de quinase isolados são apenas parcialmente estáveis, com valores de Tm em torno de 40 ºC, (figura 1). Em longo prazo, a aplicação de técnicas como essas para a caracterização de uma proteína alvo antes da realização de estudos mecanicistas detalhados pode ser econômica em termos de tempo e dinheiro, ajudando a evitar resultados artefactuais e incorretos devido à baixa qualidade da proteína. As baixas temperaturas de fusão de domínios de quinase indicam possivelmente baixa estabilidade e realçam a necessidade de melhores protocolos de purificação e condições de armazenamento e análise.
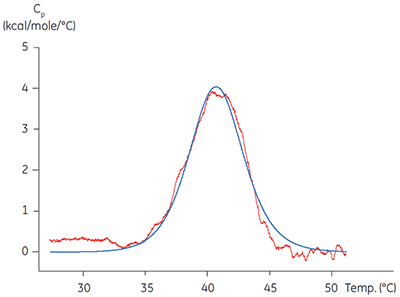
|
As informações sobre a possibilidade de a presença de outro ligante influenciar a atividade biológica de um composto de teste são cruciais para descoberta do fármaco. Um segundo ligante poderá: não ter efeito sobre a atividade do composto de teste; competir direta ou indiretamente com a ligação do composto; talvez ser realmente necessário para que o composto de teste tenha efeito.
Entender o funcionamento do mecanismo de ação do composto de teste pode ser útil para interpretar ou prever a atividade celular a concentrações de substrato diferentes das utilizadas para medir valores IC50. Isso também pode oferecer uma perspectiva sobre a relevância de estruturas 3D, que podem ser aplicadas para diferentes complexos intermoleculares. As informações sobre o mecanismo de ação também podem ser utilizadas para organizar as análises posteriores, que podem visar um determinado complexo intermolecular. Os inibidores de quinase podem preferencialmente se ligar a ou induzir conformações não ativas de quinase de proteína. A comparação da afinidade de ligação do composto de teste de cada uma dessas formas também é valiosa para decidir se deve dar continuidade ao desenvolvimento de compostos com ligação a formas ativas ou não ativas da proteína. Decisões desse tipo afetarão os processos posteriores envolvidos na descoberta do fármaco de quinase.
Assim como com todas as enzimas terapêuticas importantes, as quinases não são simplesmente um alvo molecular individual para intervenção de composto. Durante o ciclo catalítico, a quinase liga o substrato da proteína, ATP, intermediários e produtos (figura 2). Essas formas diferentes de enzima também podem existir em muitas conformações diferentes. Há formas diferentes de enzima às quais os compostos podem ser direcionados e para as quais podem ser elaboradas diferentes análises bioquímicas. A concentração fisiológica de ATP é aproximadamente 2 mM, o que significa que o ATP é capaz de competir, muitas vezes eficientemente, com compostos com ligação no local do ATP. Dessa maneira, pesquisar compostos que realizam ligação antes ou depois do ATP (chamados compostos não competitivos) ou os que realizam ligação somente após o ATP (chamados compostos não concorrentes) são ambas abordagens interessantes para a descoberta de fármaco de quinase. No entanto, muitos inibidores de quinase históricos têm como alvo o local do ATP da enzima e devem competir com o ATP para ligação à enzima. Outros compostos podem visar locais alostéricos, que, a princípio, não devem exibir essa competição com o ATP. A caracterização do mecanismo de ação de compostos permite identificar se a presença de ATP, ou do próprio substrato da proteína, aumenta, diminui ou não tem efeito sobre a afinidade do composto de teste. Estudos dessa natureza são valiosos para entender as relações estrutura-atividade (SAR) em um nível molecular e é a chave para a pesquisa de farmacóforos originais.
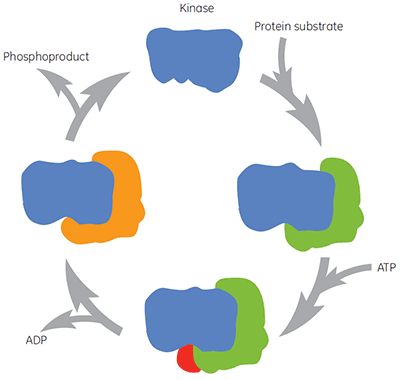
|
Normalmente, as análises cinéticas de enzimas não são organizadas para preencher formas particulares de enzima que ocorrem ao longo do processo da reação. Como resultado, pode ser difícil obter informações sobre a forma de enzima relevante para afinidade máxima diretamente. A ITC pode contornar essa limitação medindo as afinidades de ligação de formas de enzima diferentes e predeterminadas. A ligação a uma enzima livre é a abordagem mais simples, mas as condições da ITC podem ser dispostas de maneira a sondar outras formas de enzima, como substrato enzima-proteína, enzima-ATP, enzima-ADP ou complexos enzima-fosfoproduto, dependendo do mecanismo de catálise. O uso de análogos de ATP não hidrolisáveis também pode ser valioso na sondagem de possíveis ligações de compostos ao complexo ternário da enzima com ambos os substratos.
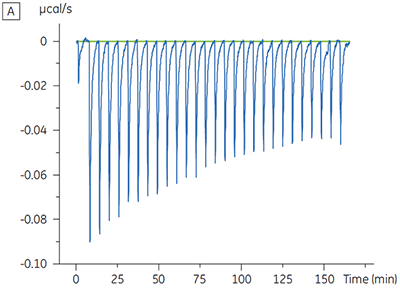
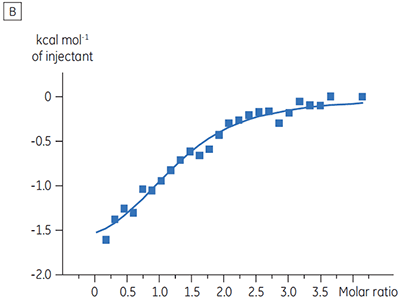
Os experimentos para caracterizar o efeito do ATP sobre a ligação de um composto de teste foram realizados para um alvo de quinase de proteína. As titulações da ITC foram realizadas com o MicroCal™ VP-ITC da Malvern para um composto de teste na presença e ausência de 100 µM ATP, representando aproximadamente 60 × KD para ATP (figura 3).
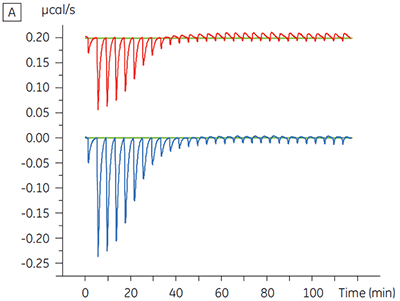
|
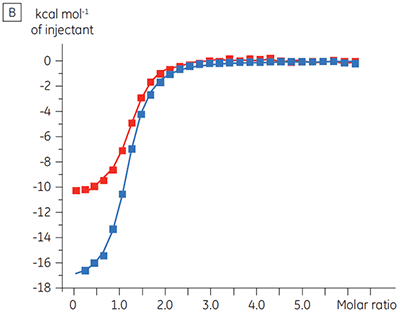
|
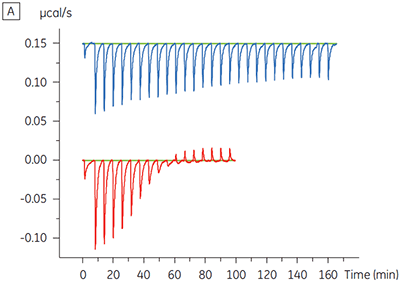
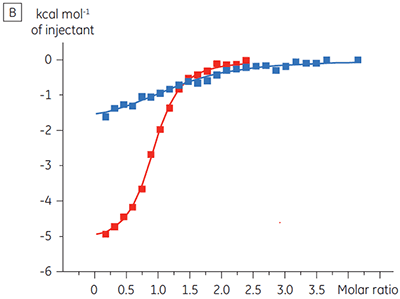
Os resultados da ITC mostram claramente que não há alteração na afinidade para a ligação do composto à quinase quando o ATP é incluso na célula com a proteína. Os valores de entalpia indicam que, embora não haja efeitos à afinidade, há um efeito significativo à entalpia da ligação. Esses resultados, portanto, sugerem que o composto é não competitivo em relação à ligação de ATP e que pode haver alterações no modo de ligação na presença de ATP. Isso realça não somente que a ITC é útil na caracterização de detalhes mecanicistas de ligação do composto, mas também que a dupla natureza de sondagem da técnica é valiosa para a medição de afinidade e entalpia de ligação. Em um experimento similar, foi observada a cinética não concorrente com relação ao ATP para a ligação de um componente de teste diferente para a mesma quinase de proteína. Na ausência de ATP, o KD foi > 50 µM (não mensurável na execução de ITC padrão), enquanto na presença de ATP foi medida a 0,7 µM. (Figura 4).
|
|
A vantagem de poder monitorar diretamente a ligação a complexos de proteína individuais também foi demonstrada em outro exemplo, em que havia suspeita de ligação de alta afinidade para um complexo de duas quinases consecutivas em um caminho de sinalização. A ITC permitiu o estudo do composto em relação à quinase à montante ("upstream") individual e também a um complexo das quinases à montante e à jusante ("upstream e downstream"), após demonstrar, primeiro, que houve a formação desse complexo. Foi demonstrado um aumento em cinco dobras da afinidade para a ligação do composto ao complexo (figura 5).
|
|
Os métodos de calorimetria se mostraram valiosos no estudo de inibição de quinase de proteína. Eles facilitam as verificações de controle de qualidade em proteínas alvo, assim como contribuem para a dissecação e compreensão dos mecanismos de ligação do inibidor.
O advento de instrumentos de alto rendimento e automatizados, como os sistemas MicroCal Auto-iTC200 e MicroCal VP-Capillary DSC da Malvern, agregou valor a essas aplicações. Os esforços contínuos em direção a um baixo consumo de reagentes garantirá que os métodos calorimétricos permaneçam incorporados ao processo de desenvolvimento de fármacos racional.
Geoff Holdgate, Cientista principal, Global Compound Sciences, Lead Generation- Discovery Capabilities & Sciences, Astra Zeneca Pharmaceuticals, Mereside, Alderley Park, Macclesfield, SK10 4TG, RU