Os dados da DSC foram usados para identificar as condições de eluição com a maior estabilidade para a etapa de captura de anticorpos durante o processo de desenvolvimento de uma proteína e o resultado na redução de custos.
O desenvolvimento de processo biofarmacêutico pode ser oneroso e demorado. O objetivo final é aumentar o rendimento do produto purificado por meio do caminho mais econômico, reproduzível e robusto. Como as falhas em lotes podem ter grandes consequências econômicas, é fundamental ter um entendimento completo da estabilidade da proteína em todo o caminho de desenvolvimento, da pesquisa ao desenvolvimento clínico e à fabricação comercial, para a comercialização de fármacos biofarmacêuticos.
É essencial manter a estabilidade e preservar a estrutura ativa de um produto biofarmacêutico de proteína até sua administração. Isso é possível, em parte, por meio de estudos de estabilidade elaborados para que se entenda o comportamento físico de produtos biofarmacêuticos. As proteínas tipicamente apresentam problemas inerentes de estabilidade devido a sua complexidade e estrutura delicada. Durante o desenvolvimento de processo, são indispensáveis os estudos de estabilidade para determinar o efeito de vários fatores ambientais (como pH, temperatura e força iônica) sobre a integridade conformacional de uma proteína, que influencia diretamente a atividade biológica. Esses estudos de tensão ajudam a identificar recursos críticos ao revelar os pontos fracos na molécula e fornecem uma abordagem racional à identificação de mecanismos de desnaturação e ao desenvolvimento de contramedidas eficazes, por meio da seleção do tampão, pH, força iônica e excipientes adequados.
|
A realização de estudos de estabilidade paralelamente ao desenvolvimento do método de purificação permite que os cientistas desenvolvam métodos mais eficazes. Durante o desenvolvimento de processos de purificação, os estudos de estabilidade podem:
Os estudos de estabilidade também auxiliam no desenvolvimento de análises robustas e indicadoras de estabilidade. Esses dados permitem o desenvolvimento acelerado de formulações para fármacos, por meio da redução da faixa de condições que devem ser exploradas durante os estudos de desenvolvimento de formulação típicos. Isso, por sua vez, significa recursos, custos e economias.
Essa nota de aplicação tem como foco o uso da calorimetria de varredura diferencial (DSC) para guiar o desenvolvimento de processos de purificação de anticorpos. Em particular, essa nota descreve como os dados da DSC foram utilizados para identificar as condições de eluição ideais durante o desenvolvimento da etapa de coleta da proteína A, que resultou em economias no estágio de fabricação clínica inicial.
A DSC fornece um modo de monitorar a estabilidade da proteína durante todo o processamento e manuseio. Isso pode resultar na melhoria das condições que podem proteger a molécula, caso ocorram condições ou comportamentos de proteína atípicos durante o desenvolvimento do processamento ou da análise.
Todas as proteínas foram preparadas no tampão indicado por meio de diálise ou intercâmbio de tampão com uma coluna de dessalinização PD-10 (GE Healthcare). As concentrações proteicas finais foram de aproximadamente 1 mg/ml. As proteínas foram analisadas como sistema MicroCal VP-DSC da Malvern utilizando uma faixa de temperatura de 5 ºC a 90 ºC, a uma taxa de varredura de 1 ºC por minuto. As análises de termogramas foram realizadas com software Origin™, utilizando um modelo de dois estados ou sem dois estados.
A cromatografia por afinidade da proteína A é comumente usada como a etapa de coleta inicial para a purificação de anticorpos monoclonais. A proteína A se liga à região Fc de muitas moléculas de anticorpos de imunoglobulinas (Ig). Essa especificidade e seletividade de ligação podem resultar em um produto quase puro em uma única etapa. As moléculas de anticorpos são produzidas por cultura celular e precisam ser purificadas em relação às proteínas da célula hospedeira, ácidos nucleicos e componentes da cultura celular. O meio de cultura celular sem células é aplicado ao meio de cromatografia por afinidade da proteína A. Os anticorpos se ligam à proteína A imobilizada a um pH neutro (em torno de pH 7) e são eluídos com um tampão de baixo pH (por exemplo, tampão de citrato a um pH 3,5). Os anticorpos eluídos são neutralizados com uma solução com alta capacidade de tamponamento
como 1 M tris pH 9 ou por meio de dessalinização.
Um problema resultante do uso de cromatografia por afinidade da proteína A é que os anticorpos, assim como outras proteínas, podem se tornar instáveis no pH baixo necessário para a eluição. Se a proteína se tornar instável a um pH baixo, ela poderá se precipitar durante ou após a eluição.
A precipitação geralmente depende da concentração da proteína: a alta concentração favorece a agregação e precipitação. Assim, embora a maioria dos meios de cromatografia possa estabelecer ligação a pelo menos 20 g de anticorpo por litro de meio, a estabilidade da proteína a um pH baixo, pós-eluição, se torna um fator limitador para o carregamento do meio. Embora muitos anticorpos sejam sensíveis ao pH, o mecanismo de desnaturação
e agregação varia conforme a estrutura e exigirá diferentes tampões para a estabilidade ideal.
Para melhorar a capacidade de carregamento e a economia do processo de cromatografia da proteína A, é necessário estabilizar a proteína no tampão de eluição. A DSC pode ser utilizada para caracterizar a estabilidade do anticorpo como uma função de pH e determinar quais aditivos podem melhorar a estabilidade da proteína um pH baixo. Na DSC, um aumento na temperatura de transição (Tm) sugere um aumento na estabilidade da proteína. A etapa de cromatografia da proteína A pode se tornar mais economicamente viável por meio da estabilização do anticorpo no tampão de eluição de baixo pH, consequentemente aumentando a capacidade de carregamento.
Em um estudo de caso, um cliente desejava melhorar o processo de purificação de seu anticorpo (anticorpo X). As informações do processo indicaram que a capacidade de ligação inicial estava limitada a 2 g do anticorpo X por litro de meio de proteína A devido à precipitação do anticorpo durante a eluição a um carregamento maior. Para entender o efeito do pH sobre a estabilidade do anticorpo X, a proteína foi preparada em quatro tampões diferentes; tampão de citrato ajustado com Tris para pH 7,0; tampão de fosfato de pH 7,3; tampão de citrato de pH 3,5; e tampão de citrato de pH 5,0. Com base nos dados da DSC (tabela 1), anticorpo X a um pH 7,0 e 7,3 apresentou um Tm superior à do anticorpo de pH 3,5, indicando que a proteína permaneceu mais estável a um pH superior. As temperaturas de princípio de desdobramento também se mostraram superiores para pH 7,0 e 7,3 comparado ao pH 3,5. O anticorpo X a um pH 5,0 apresentou um Tm comparável a pH 7,0, e a temperatura de princípio de desdobramento foi inferior, sugerindo que o pH desempenha um papel importante na determinação do desdobramento desse anticorpo.
| Tm da principal transição | Princípio de desdobramento (°C) | |
|---|---|---|
| Tampão Tris de citrato, pH 7,0 | 68,7 | 60,1 |
| PBS, pH 7,3 | 69,5 | 58,5 |
| Citrato, pH 5,0 | 71,5 | 48,2 |
| Citrato, pH 3,5 | 59,3 | 34,1 |
| Citrato + manitol, pH 3,5 | 64,7 | 41,0 |
O anticorpo X também foi preparado em tampões de baixo pH com aditivos diferentes para determinar se algum desses aditivos poderia estabilizar o anticorpo a um pH baixo. Os experimentos de DSC foram realizados para se determinar quais condições aumentariam o Tm do anticorpo (figura 2).
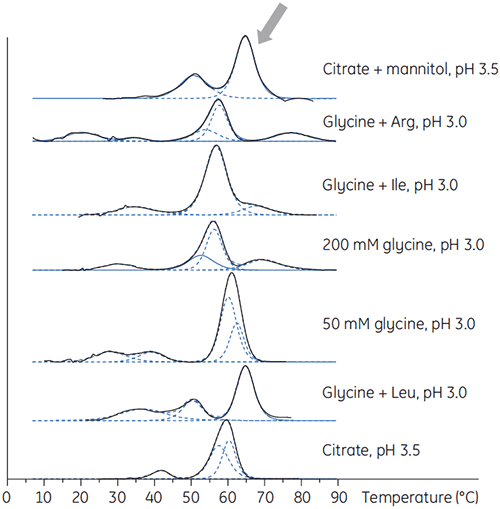
|
Para o anticorpo X, citrato e manitol a um pH 3,5 resultou na maior alteração de Tm, indicando a estabilidade mais favorável. A adição de manitol aumentou o Tm e a temperatura de princípio de desdobramento relativas ao citrato a pH 3,5. (Figura 3).
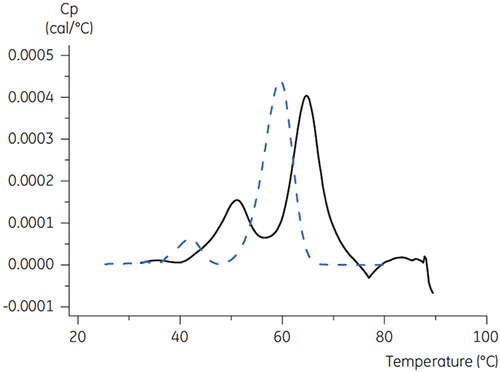
|
Os resultados da DSC sugeriram que a adição de manitol ao tampão de eluição para o meio de afinidade da proteína A melhorariam a estabilidade do anticorpo X. A estabilidade do anticorpo aperfeiçoada durante a eluição pode aumentar o carregamento do anticorpo no meio de cromatografia da proteína A.
Os esforços de desenvolvimento de processo utilizando as informações de estabilidade da proteína determinados a partir da DSC realmente resultaram em um aumento do carregamento do anticorpo X durante a etapa de coleta da proteína A. O uso de citrato e manitol como o tampão de eluição da proteína A resultou em um aumento de pelo menos 7,5 dobras na capacidade para ≥15 g de anticorpo X por litro do meio da proteína A, comparado a 2 g por litro com tampão de apenas citrato.
O anticorpo X se apresentou mais concentrado após a etapa de coleta da proteína A do que no processo inicial, eliminando uma etapa de ultrafiltração/diafiltração e resultando em economia de material e tempo de processamento.
Nessa nota de aplicação, os dados da DSC foram utilizados para identificar a maioria das condições de eluição estabilizantes para a etapa de coleta do anticorpo durante o desenvolvimento de processo de uma proteína. A DSC fornece informações valiosas para escolher as condições de tamponamento estabilizantes antes da execução do desenvolvimento cromatográfico. A capacidade de melhorar o desempenho nessa etapa crítica no desenvolvimento de processos de purificação pode resultar em uma economia financeira considerável durante o processo.
Essa nota de aplicação foi autorizada por Prathima Acharya, previamente com Diosynth Biotechnology. Também é reconhecida a contribuição de Rochelle Bazemore, Sorina Morar, Sue Cook e Jessica Weaver do Purification Development Group a esse trabalho.