Nessa nota de aplicação, o MicroCal VP-Capillary DSC foi utilizado para a seleção rápida de tampões em desenvolvimento de pré-formulação e para a otimização de condições de armazenamento de anticorpos durante o desenvolvimento do processo. Os resultados apresentam boa correspondência com os obtidos por outros métodos mais demorados.
O uso de produtos bioterapêuticos, como anticorpos e outras moléculas de proteínas, para tratar doenças é um campo em crescimento acelerado na indústria farmacêutica. Geralmente, os produtos bioterapêuticos são necessários a altas concentrações e em doses múltiplas, o que exige que o fabricante produza quantidade em quilogramas ou mais do fármaco da proteína. O processo de fabricação dos produtos bioterapêuticos envolve a expressão de proteínas em milhares de litros de meio biorreator seguida de um processo de purificação que utiliza colunas de cromatografia e sistemas de filtragem em larga escala.
A estabilidade da proteína em relação a condições de processo, reversibilidade das alterações conformacionais qualquer tendência à formação de agregados depende de fatores como pH e composição do tampão. É importante ter um entendimento completo desses fatores para a seleção de condições de processo, formulação e desenvolvimento de métodos de análise. As etapas do processo de purificação do anticorpo que podem tornar uma proteína instável incluem etapa de eluição com baixo pH da coluna de proteína A, etapa de contenção com baixo pH para inativação viral e qualquer estágio que envolva ajuste de pH e/ou força iônica, inclusive a formulação final.
A calorimetria de varredura diferencial (DSC) fornece informações sobre a estabilidade térmica de uma proteína sob condições de diferentes pH e consolutos, monitorando os pontos intermediários de transição térmica, Tm. Um Tm maior reflete uma estabilidade térmica maior, que se correlacionam bem com estabilidade de longo prazo. Essa nota de aplicação descreve como a Diosynth Biotechnology utiliza dados de estabilidade térmica da DSC para caracterizar a estabilidade de um anticorpo durante a seleção inicial de pH e tampão para desenvolvimento de pré-formulação e otimização da inativação viral de baixo pH utilizados no processo de fabricação. A inativação viral de baixo pH é desejável para fabricação de proteína, desde que não reduza a estabilidade da proteína.
A DSC foi executada utilizando um sistema MicroCal VP-Capillary DSC da Malvern. No estudo de desenvolvimento de pré-formulação, foi utilizada uma série de tampões com pH entre 3 e 8. A proteína (anticorpo X) foi armazenada em cada tampão, e as análises foram realizadas imediatamente (t = 0) e após uma semana de armazenamento (t = 1 semana).
Para a otimização de condições de purificação, os termogramas da DSC de anticorpo Y (em um tampão Tris neutro com NaCl e EDTA, pH 7,4) foram estudados e comparados a um tampão de citrato de pH 3, e o tampão de citrato foi ajustado para pH 6 com 2 M Tris, pH 9,0.
Os termogramas apenas do tampão foram subtraídos de cada proteína antes da análise com o software Origin™ 7.0 equipado com software de análise MicroCal VP-Capillary DSC.
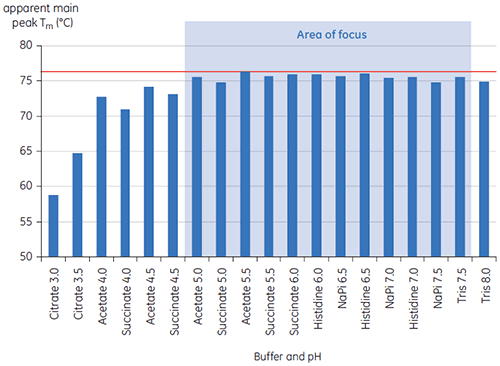
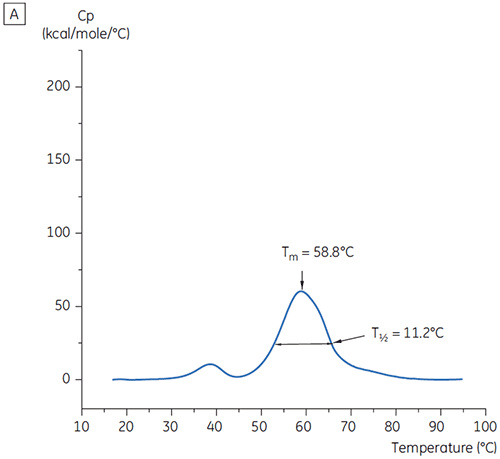
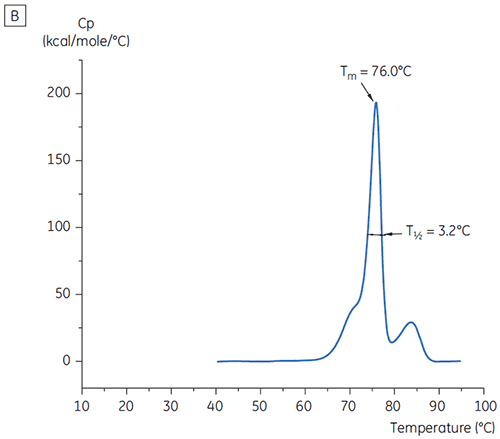
Os valores do pico principal de Tm a t = 0 para anticorpo X no estudo inicial de 19 tampões para o desenvolvimento de pré-formulação são mostrados na figura 1. Os termogramas de DSC para o anticorpo em dois desses tampões são mostrados na figura 2. Dos valores de Tm, as condições de tampão mais estáveis são encontradas entre pH 5,0 e pH 7,5. Quando t = 0, outros métodos analíticos (UV, cromatografia por exclusão de tamanho [SEC], espalhamento de luz e SDS-PAGE) indicaram muito menos discriminação entre as condições do tampão em relação à DSC (dados não mostrados).
|
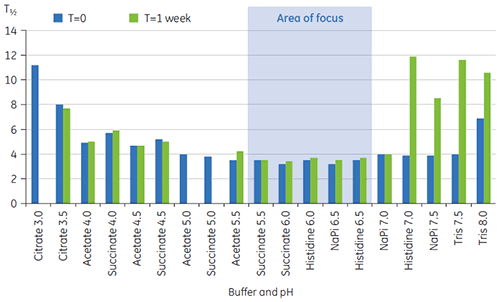
Os valores T½ foram utilizados para aprofundar a discriminação entre as condições, conforme indicado na figura 2. T½ é a largura de pico na metade da altura máxima para a maior transição no termograma da DSC e normalmente reflete a cooperatividade da transição térmica. Um valor T½ inferior pode indicar uma estrutura mais compacta e, portanto, é privilegiada em caso de formulações. Aqui, os valores T½ mais baixos foram encontrados para tampões com valores de pH entre 5,5 e 6,5 (figura 3).
|
|
|
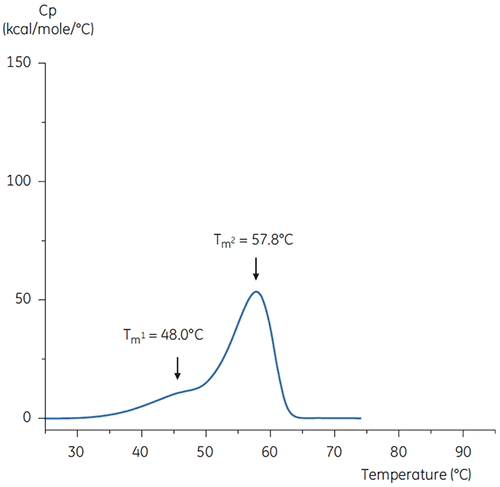
O tampão de citrato com pH 3 é um candidato para uso na eluição do anticorpo da coluna de afinidade da proteína A e para a etapa de contenção de baixo pH subsequente para inativação viral. Como a maioria das proteínas tende a se tornar instável sob exposição prolongada a esse pH baixo, o pH deve ser aumentado imediatamente após a etapa de inativação viral.
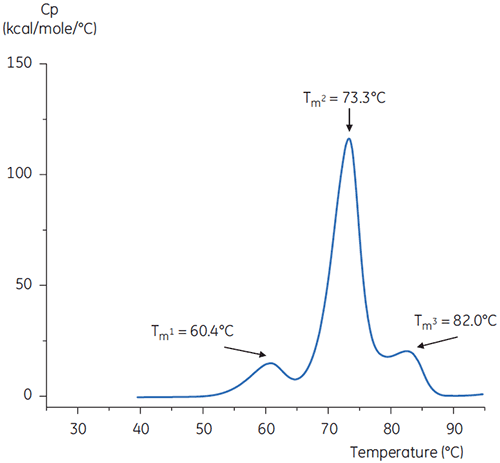
As varreduras da DSC do anticorpo no tampão a um pH neutro e um pH 3 são mostradas nas figuras 4 e 5.
|
|
As diferenças em formato e padrão dos dois termogramas demonstra uma perda de estabilidade térmica do anticorpo no tampão de pH 3,0. A altura de pico da transição de Tm2 é inferior, o pico maior e a definição entre a primeira e segunda transições em pH 3,0 é menos pronunciada do que em relação a um pH 7,4.
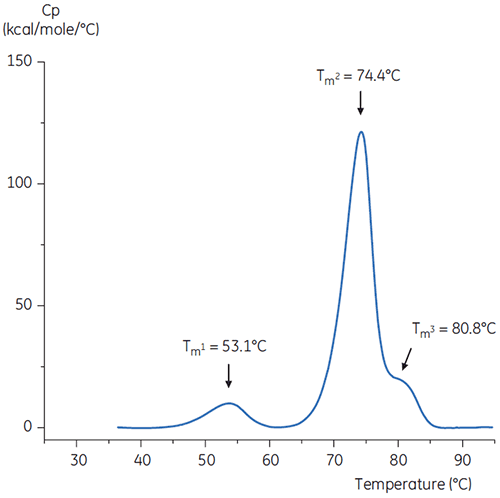
Para imitar a etapa de neutralização de pH, o pH da solução de anticorpos foi ajustado para pH 6,0 com uma solução Tris concentrada a um pH 9. O termograma da solução de anticorpos resultante é mostrado na figura 6. Aqui é possível observar uma estabilidade térmica aumentada relativa ao anticorpo em tampão de pH 3,0. O Tm2 e Tm3 do anticorpo na solução de pH 6,0 são similares à Tm2 e Tm3 do anticorpo no tampão de referência. O formato geral, definição de pico e largura de pico para os anticorpos de pH 6 também são similares à situação de referência com pH 7,4.
A neutralização também pode ser realizada na presença de excipientes estabilizantes, como histidina. Nesse caso, o termograma do anticorpo neutralizado na presença de histidina foi quase idêntico ao da figura 6, indicando que, para esse anticorpo em particular, a histidina não forneceu nenhum efeito estabilizante significativo.
|
Esse estudo mostra que foi possível utilizar a DSC para rapidamente otimizar as condições de pH e tampão para desenvolvimento de pré-formulação. Esses dados foram utilizados para classificar os tampões e o intervalo de pH para a seleção de excipientes seguinte, reduzindo o número de condições exploratórias consideravelmente.
A DSC também pode ser utilizada para verificar a estabilidade de um anticorpo durante a etapa de contenção de inativação de baixo pH e o ajuste posterior do pH de 3,0 para 6,0. Esse tipo de informação sobre estabilidade é útil para o planejamento e a otimização dos processos para fabricação de produtos biofarmacêuticos.
Esses dados foram gentilmente fornecidos pela Dra. Kathrine E. Bowers, FUJIFILM Diosynth Biotechnologies USA Inc.