Esta nota de aplicação descreve como o Malvern MicroCal iTC200, que oferece o consumo de amostra baixo e alto rendimento necessários para impulsionar a produção, foi implementado em um fluxo der trabalho com base no desenvolvimento de estes para gerar otimização.
O objetivo da pesquisa farmacêutica é modular a atividade de um alvo, de maneira que seja gerada uma resposta terapêutica benéfica. Normalmente, um fármaco é eficiente apenas quando associado à e modulando a atividade de seu(s) alvo(s) fisiológico(s). Consequentemente, o foco da descoberta do fármaco em um estágio primário se concentra na otimização da afinidade e da seletividade do alvo de um fármaco candidato.
A calorimetria de titulação isotérmica (ITC) é amplamente utilizada para medir os parâmetros de ligação termodinâmicos para interações entre pequenas moléculas e proteínas. A medição simultânea da afinidade de ligação (KD), estequiometria (n), energia livre (ΔG), entalpia (ΔH) e entropia (ΔS) fornece informações importantes em muitos estágios do processo de descoberta do fármaco.
Os exemplos a seguir ilustram como as informações de ligação detalhadas fornecidas pelo sistema MicroCal iTC200 contribuem em diferentes estágios da descoberta do fármaco.
Um estudo envolve a avaliação da ligação de peptídeos a proteínas alvo durante o desenvolvimento da análise. O objetivo é obter um conhecimento maior sobre os mecanismos de ligação de uma proteína alvo e uma possível substância medicamentosa futura. Além disso, os dados resultantes, especialmente de estequiometria (n) e afinidade (KD), podem ser utilizados para avaliar a qualidade e a atividade de preparações de proteína alvo posteriores.
Uma segunda aplicação utiliza a ITC como método ortogonal para examinar ocorrências ligadas a uma proteína alvo, após a seleção principal. Um resultado positivo da ITC combinada a dados de análise bioquímica e dados de outras técnicas biofísicas (como ressonância de plásmon de superfície (SPR) e ressonância magnética nuclear (NMR)), ajuda a distinguir com precisão as ocorrências verdadeiras das falsas.
O estudo final investiga as contribuições da entalpia e entropia da energia livre para compostos no principal estágio de otimização. A medição simultânea da afinidade de ligação (KD), estequiometria (n), energia livre (ΔG), entalpia (ΔH) e entropia (ΔS) fornece informações importantes que dão suporte ao desenvolvimento posterior dos componentes principais. As contribuições da entalpia e entropia à energia de ligação fornecem pistas sobre como um possível fármaco irá interagir com o alvo. Essas informações podem ser utilizadas para desenvolver relacionamentos entre estrutura e atividade e fornecer suporte a um design de fármaco assistido por computador.
Embora a ITC forneça essas informações valiosas e detalhadas em um único experimento, nem sempre essa tecnologia foi aplicada de maneira abrangente na descoberta de fármacos devido ao consumo significativo de proteínas e compostos associado a metodologias convencionais. A introdução do MicroCal iTC200 resolveu essa questão. Comparado à versão mais antiga dos sistemas ITC, ele fornece uma redução de sete dobras em consumo de amostra e tempos de equilíbrio duas a quatro vezes mais rápidos, o que resulta em maior produção.
Todas as proteínas e compostos de moléculas pequenas foram produzidos internamente na Hoffmann La-Roche. O instrumento MicroCal iTC200 está disponível entre os instrumentos da Malvern. Todos os experimentos foram realizados a 25 °C.
Todos os tampões foram desgaseificados antes do uso. A célula de amostra foi preenchida com Bcl-2 (30 µM solução) em 50 mM HEPES, pH 7,4, 100 mM NaCl, 0,5 mM TCEP e 5% DMSO. Os peptídeos foram diluídos a uma concentração de 250 µM no mesmo tampão. Os volumes de injeção foram 3 µl cada, tempo de injeção 6 s, e um atraso de 150 s entre cada injeção. Os dados foram analisados utilizando software Origin™ habilitado pelo MicroCal (OriginLabs).
|
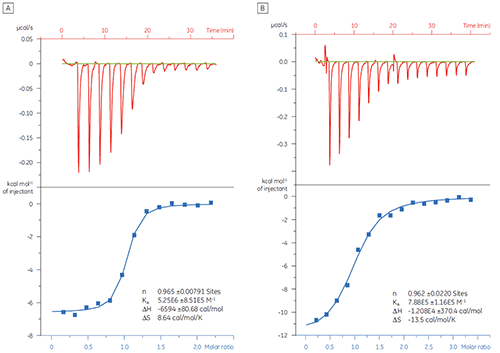
Os dados de ITC, especialmente estequiometria (n) e afinidade constante (KD), foram utilizados para avaliar a qualidade das preparações de proteína.
Nesse exemplo, a interação de dois peptídeos diferentes com o alvo de proteína Bcl-2 (nome derivado do linfoma de células B 2) foi estudada com o MicroCal iTC200. Os resultados são mostrados na figura 1. A afinidade de ligação do peptídeo semelhante à BAD (promotor de morte associado à Bcl-2) com a proteína Bcl-2 é aproximadamente seis dobras mais forte do que a do peptídeo BAX (proteína X associada à Bcl-2).
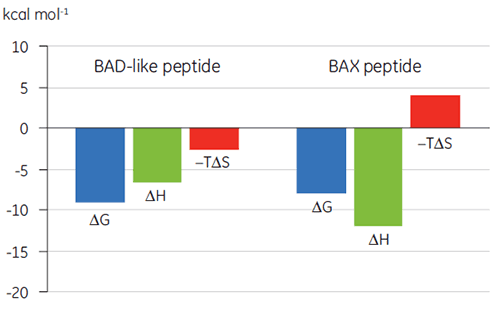
A visualização dos parâmetros termodinâmicos no formato de gráfico de assinatura de ligação (Fig 2) facilita a percepção de como os componentes entálpicos e entrópicos contribuem para a afinidade geral, representada aqui por ΔG. Esses gráficos revelam que a ligação do peptídeo semelhante à BAD a Bcl-2 é composta de interações polares e hidrofóbicas, conforme indicado pela entalpia de ligação (ΔH) e o fator de entropia (TΔS) negativos ou favoráveis. A ligação de BAX envolve alterações mais conformacionais, conforme indicado pela entropia não favorável.
|
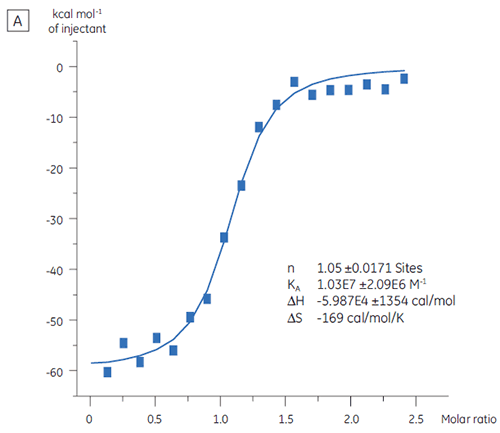
A ITC pode ser utilizada para avaliar o nível de atividade de ligação da proteína alvo antes de seu uso em uma campanha de seleção. Nesse estudo, foram comparados dois lotes de uma proteína alvo por meio de titulação com um peptídeo de controle positivo ligado à proteína alvo com uma afinidade de 97 nM (Fig 3).
|
|
O resultado para o primeiro lote, Lote A (Fig 3 A), demonstra uma curva isotérmica prevista com um KD de 97 nM e n = 1, indicando uma proteína totalmente ativa. O segundo lote, Lote B (Fig 3 B), tem um KD de 135 nM, mas apresenta apenas 0,23, indicando uma proteína que está parcialmente ativa. A análise do mesmo conjunto de dados, mas com uma concentração de proteína de 2,3 µM em vez de 10 µM, fornece o mesmo valor de KD e n = 1. Isso indica que 75% das proteínas do Lote B estavam inativos. A proteína do Lote B foi rejeitada para
uso na campanha de seleção.
É importante separar os falso-positivos de uma campanha de seleção nos primeiros estágios. Uma solução de 20 µM da proteína alvo (TP) foi titulada com Composto X (Fig 4). O KD (definido como 1/KA) foi determinado como 4,9 µM, o que se correlaciona bem com os estudos realizados com SPR e NMR, confirmando que o Composto X é uma ocorrência verdadeira e adequada para estudos posteriores.
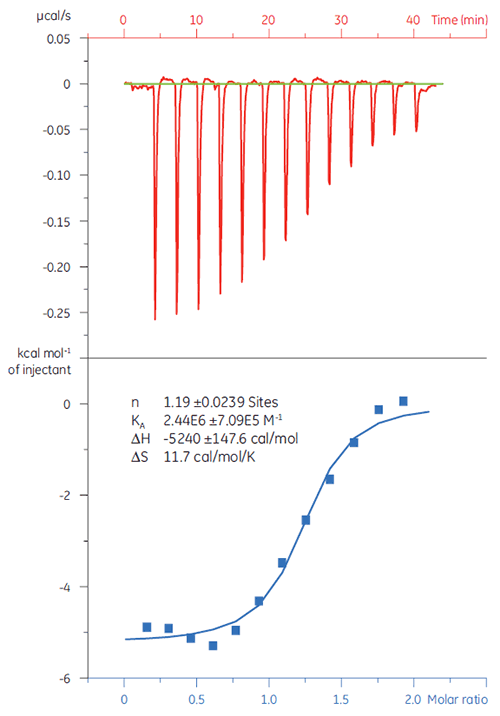
|
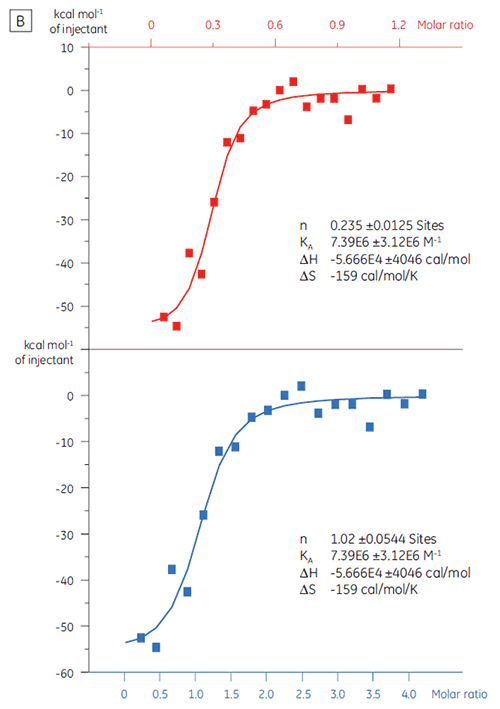
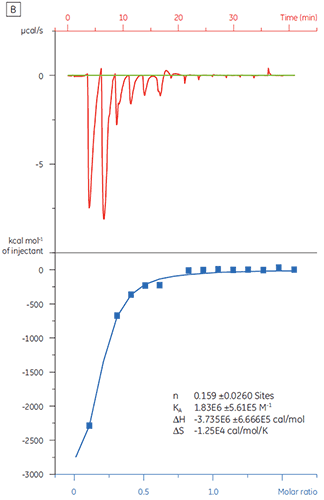
Quando a mesma proteína alvo foi titulada com o Composto Y, os resultados foram muito diferentes (Fig 5). No painel esquerdo, o Composto Y foi titulado com TP. A curva isotérmica mostra uma afinidade de ligação aparente de 120 nM, mas a entalpia de ligação foi quase 1.000 dobras superior ao esperado e o valor de estequiometria muito baixo (n = 0,01). No painel direito, o mesmo fármaco candidato foi titulado com albumina do soro bovino (BSA). Considerados como um todo, os resultados indicam atividade não específica. Com base nesses experimentos, o Composto Y foi considerado um falso-positivo e rejeitado para estudos posteriores.
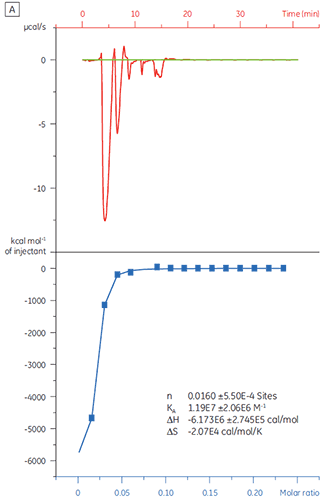
|
|
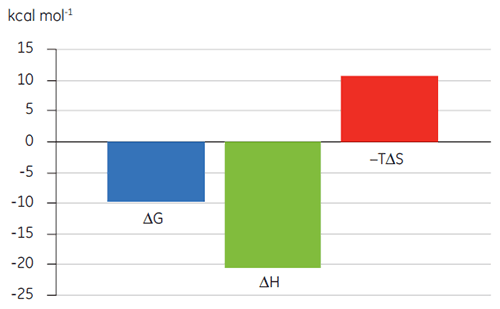
Estudos anteriores da ligação do Composto A a TP sugeriram um KD de 25 nM. Para caracterizar mais detalhadamente a termodinâmica dessa interação, foi realizado o experimento de ITC (Fig 6). Uma solução de 100 µM de Composto A foi titulada em uma solução de 10 µM de TP e o valor de KD foi 65 nM. A assinatura de ligação (Fig 7) mostra que a afinidade é fortemente impulsionada pelas interações entálpicas, mas entropicamente oposta.
As interações entálpicas são tipicamente conduzidas pela ligação de hidrogênio e interações van der Waals, enquanto a afinidade de ligação entrópica favorável é derivada de interações hidrofóbicas. A entropia desfavorável, como neste exemplo, resulta de uma redução geral nos graus de liberdade das espécies em interação relativas ao complexo. Isso sempre ocorre quando duas moléculas interagem, mas a magnitude do efeito sugere que a proteína foi sujeita a uma alteração conformacional ou que o ligante é muito flexível. A redução nessa entropia desfavorável oferece um caminho de otimização definido, que pode ser seguido utilizando ITC.
Foi demonstrado anteriormente que é mais difícil otimizar a entalpia do que a entropia de ligação e que confiar demais na otimização de afinidade utilizando somente um desses parâmetros pode resultar em um composto com poucas propriedades farmacocinéticas (hidrofílico ou hidrofóbico demais). No conjunto, é melhor começar com um componente principal entalpicamente orientado e depois "produzir" a entropia aperfeiçoada.
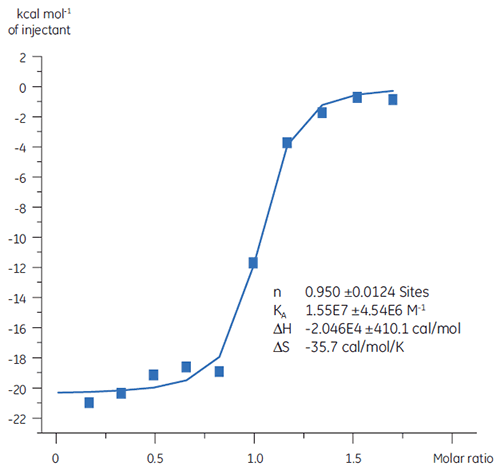
|
|
Por meio do MicroCal iTC200, a técnica ITC foi incorporada a um fluxo de trabalho de descoberta de fármaco, demonstrando que:
Os dados foram gentilmente fornecidos pelo Dr. Lin Gao, Hoffman-La Roche, Nutley NJ, EUA.