O trabalho apresentado aqui ilustra a utilização da calorimetria de varredura diferencial (DSC) nos primeiros estágios da caracterização da proteína para fornecer rapidamente dados críticos sobre estabilidade da proteína que podem ser usados como um guia para oferecer suporte à e acelerar a formulação líquida.
Existem projetos de desenvolvimento de anticorpos monoclonais para uma ampla variedade de indicações clínicas (1,2). Proteínas recombinantes de interesse comercial, inclusive anticorpos monoclonais, requerem propriedades adicionais a sua atividade biológica para permitir que sejam desenvolvidas como produtos biofarmacêuticos bem-sucedidos. Em especial, elas devem ser resistentes à degradação química e fisicamente estáveis em um determinado ambiente, sem nenhuma tendência a agregação (3,4). Além disso, elas requerem uma meia-vida sérica favorável e não devem exibir, ou exibir muito pouco, potencial imunogênico (5).
Além de sua produção ser mais onerosa em relação à de formulações líquidas, um produto liofilizado (DP) pode ser reconstituído pelo médico, demorando 10 a 20 minutos antes da administração parenteral ao paciente. A força motriz que faz com que a indústria biofarmacêutica concentre seus recursos no desenvolvimento de formulações líquidas em vez de DPS liofilizados convencionais é a administração simplificada. No entanto, há alguns problemas técnicos a serem superados com relação a formulações líquidas. O principal desafio é manter a estabilidade do produto biofarmacêutico proteico em uma formulação líquida aumentando a estabilidade física e diminuindo a degradação química. É especialmente desafiador desenvolver produtos biofarmacêuticos para administração subcutânea, pois nesse caso a formulação líquida deve apresentar a maior concentração proteica possível para compensar as limitações impostas pelo possível volume de injeção, 1,0 a 1,5 ml (6).
|
Isso gera uma pressão enorme sobre as equipes de desenvolvimento da formulação para que forneçam formulações líquidas refinadas adequadas a cada produto biofarmacêutico. A análise da estrutura e da estabilidade de proteínas recombinantes, em particular de anticorpos monoclonais, é consideravelmente importante e um pré-requisito indispensável para o desenvolvimento de formulações para produtos biofarmacêuticos. Foi desenvolvida toda uma variedade de técnicas que podem ser utilizadas para que se obtenha informações estruturais e informações sobre estabilidade proteica. A DSC se tornou um dos principais métodos físico-farmacêuticos para estudar a estabilidade de produtos biofarmacêuticos proteicos (7-11). A DSC permite o estudo rápido de desdobramento proteico sem marcações ou uso de sondas artificiais. A técnica determina o calor absorvido pela amostra à medida que a proteína é desdobrada, fornecendo uma medida de sua termoestabilidade e uma indicação de sua estabilidade em longo prazo.
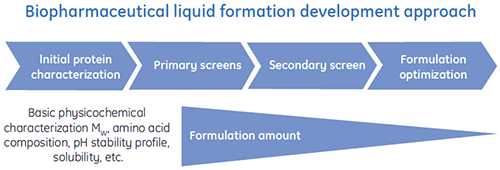
Foram criados programas de desenvolvimento de formulação líquida para fornecer formulações líquidas para produtos biofarmacêuticos com eficiência. É mostrado um esquema geral de um processo típico de desenvolvimento de formulação líquida na figura 1.
A DSC provou ser especialmente valiosa nos primeiros estágios do desenvolvimento da formulação líquida; ponto em que é preferível reduzir rapidamente o número de formulações testadas para economizar substâncias medicamentosas (DS) e tempo gastos em análises complexas.
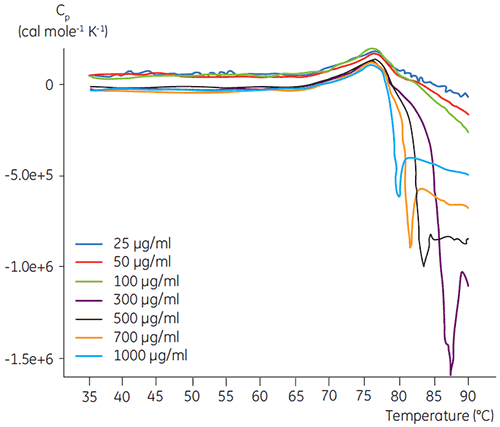
Os experimentos com DSC foram realizados utilizando MicroCal VP-DSC da Malvern (Malvern Instruments) com uma taxa de varredura de 1,5 K/min. As amostras foram desgaseificadas por cinco minutos antes da análise. Em todos os experimentos, a célula de referência do calorímetro foi preenchida com um tampão correspondente ao tampão de amostra. As linhas de base do tampão foram subtraídas das varreduras proteicas e a capacidade térmica molar foi utilizada na análise dos dados. A reversibilidade do desdobramento induzido por temperatura de todas as proteínas foi verificada por meio da comparação das varreduras de DSC de aquecimento e reaquecimento. Não foi encontrada nenhuma reversibilidade. As temperaturas de desdobramento foram adquiridas por meio da análise dos perfis calorimétricos de acordo com um modelo de transição de dois estados. O sinal ideal para a proporção de ruído foi encontrado ao utilizar uma concentração de anticorpos de 100 µg/ml (figura 2). Embora concentrações mais altas não tenham impactado a temperatura de desdobramento, elas induziram um calor exotérmico forte devido à agregação da proteína após o desdobramento.
|
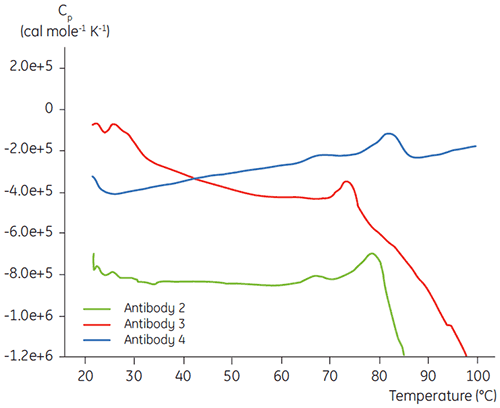
Na fase de caracterização inicial de um programa de desenvolvimento de formulação líquida de anticorpos específicos, a DSC é utilizada para fins de comparação da estabilidade geral do anticorpo a outros anticorpos em desenvolvimento. Como é possível observar na figura 3, são encontradas grandes diferenças nas temperaturas de desdobramento entre anticorpos diferentes.
|
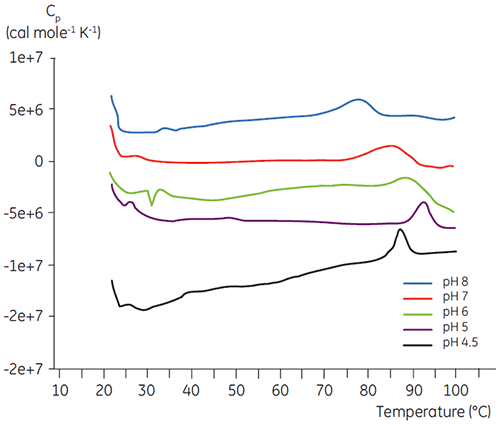
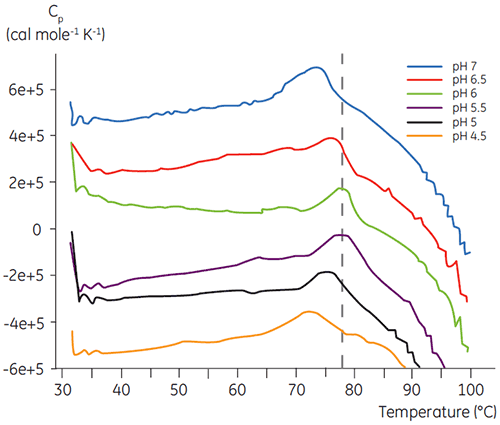
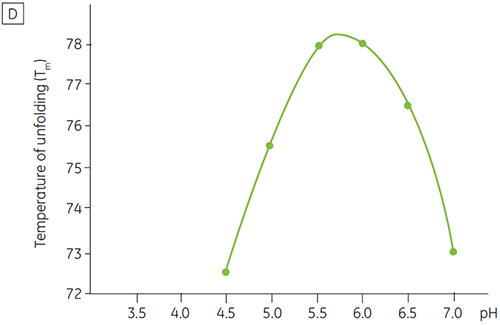
Como a maioria das proteínas, os produtos biofarmacêuticos são muito sensíveis a pH e é essencial encontrar o pH ideal para aumentar a estabilidade. A DSC se mostrou uma ferramenta eficiente para otimizar o pH, já que é possível obter informações sem a necessidade de realizar estudos de estabilidade acelerada de duas e quatro semanas. Embora a maioria dos anticorpos tipicamente apresente um nível mais alto de estabilidade entre pH 5,5 a 6, ainda é importante caracterizar o pH ideal devido aos desvios encontrados. Asa figuras 4 e 5 apresentam perfis de pH de uma proteína de fusão e anticorpo 2. Como você pode observar, o pH ideal para a proteína de fusão (figura 4) foi um pH 5, com um valor de Tm de 92,8 °C. A proteína de fusão foi desestabilizada na sequência a valores de pH acima de pH 5, mas especialmente sensíveis a valores de pH baixos. Não foi possível observar nenhum desdobramento a um pH 4 (dados não mostrados). A figura 5 mostra um perfil de pH típico de um anticorpo. A estabilidade mais alta foi obtida a um pH 5,5 e pH 6, fornecendo um valor de Tm de 78,5 °C.
|
|
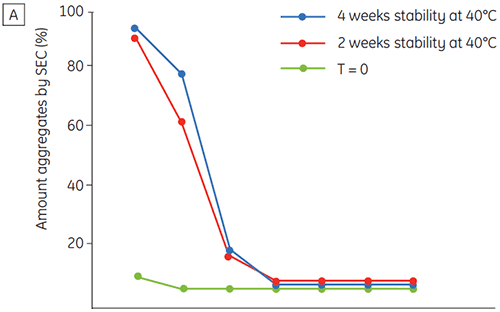
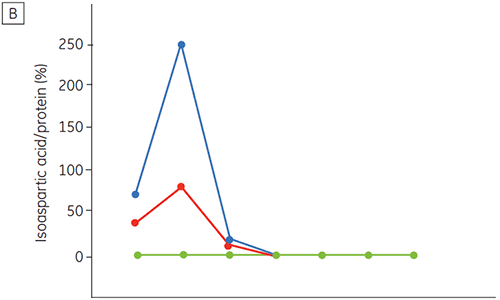
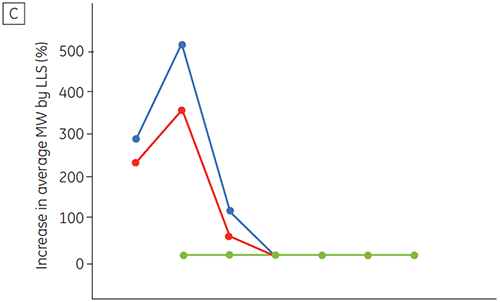
A figura 6 apresenta dados sobre a estabilidade química e física de anticorpo 2 como uma função de tempo e pH (fase de caracterização proteica inicial). O estudo do perfil de estabilidade do pH mostra que após incubar o anticorpo 2 por duas e quatro semanas a ≤pH 5 e 40 ºC, houve alterações visíveis na estabilidade. A DSC distinguiu a condição de pH ideal para esse anticorpo monoclonal utilizando somente amostras recém-preparadas (tempo zero) e fornecendo resultados similares de outros métodos (figura 5). Além disso, a DSC identificou uma desestabilização em valores de ≥pH 6,5, algo que não foi óbvio no período de suas e quatro semanas, mas para o qual teriam sido necessárias oito a doze semanas de estudo de estabilidade para elucidação. Em outras palavras, os resultados da DSC apresentam uma boa correspondência com os outros métodos utilizados nesse estudo para otimizar o pH do tampão da formulação.
|
|
|
|
O benefício da DSC é que somente as amostras tempo zero precisam ser analisadas para indicar a estabilidade. Isso porque o próprio processo de aquecimento da proteína é indutor de tensão. Normalmente, se a conformação nativa de uma proteína é estabilizada, ela poderá resistir a tensões térmicas de grau maior (desdobramento a uma temperatura maior) comparado a uma proteína desestabilizada. Assim, ao utilizar DSC, não foi necessário testar amostras quanto à estabilidade de longo prazo a diferentes temperaturas simplesmente para adquirir informações sobre o impacto de uma formulação líquida específica na estabilidade da proteína.
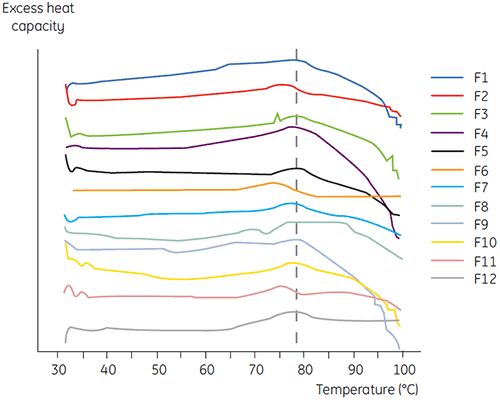
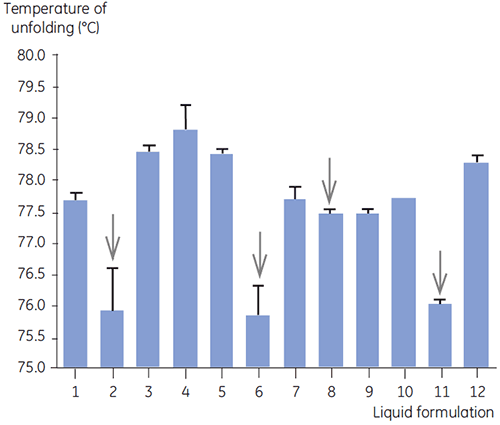
A DSC foi utilizada na seleção principal de anticorpo 2 juntamente com outros métodos biofísicos, inclusive SEC, espalhamento de luz de laser (LLS), eletroforese capilar (CE) e SDSPAGE para selecionar as formulações líquidas mais promissoras. As amostras foram submetidas a um estudo de estabilidade acelerado e analisadas após quatro semanas. A DSC se mostrou especialmente bem-sucedida na identificação de formulações que tiveram um impacto negativo no anticorpo 2, mas a técnica também identificou boas formulações líquidas. Ao analisar as amostras tempo zero, a DSC identificou todas as quatro formulações líquidas (formulação 2, 6, 8 e 11) na seleção principal classificadas como insatisfatórias de acordo com outras técnicas analíticas. A figura 7 apresenta termogramas e a figura 8 apresenta as temperaturas de desdobramento (Tm) do anticorpo 2 em formulações líquidas F1 a F12 da seleção principal. O desdobramento do anticorpo 2 na formulação F9 resultou em um padrão de desdobramento acentuadamente desviante. Por essa razão foi considerado como uma formulação crítica.
|
|
A DSC é uma tecnologia valiosa nos primeiros estágios do desenvolvimento da caracterização e da formulação da proteína. Os dados críticos sobre estabilidade da proteína podem ser adquiridos rapidamente e utilizados como um guia para oferecer suporte ao e acelerar o desenvolvimento de formulações líquidas.
Esta nota de aplicação foi autorizada pelo Dr Fredrik Ollila, Novartis Pharma AG.