
Gamme ITC MicroCal
Détermine les paramètres de liaison des biomolécules en une unique analyse
Mesure sans marquage de l'affinité et des paramètres thermodynamiques de liaison associés aux interactions entre biomolécules pour comprendre leur fonction et leurs mécanismes au niveau moléculaire
La titration calorimétrique isotherme (ITC) est une technique de quantification sans marquage utilisée dans les études d'une grande variété d'interactions biomoléculaires. Elle repose sur une mesure directe de la chaleur libérée ou absorbée durant un événement de liaison entre biomolécules.

Détermine les paramètres de liaison des biomolécules en une unique analyse
L'ITC est la seule technique capable de déterminer simultanément tous les paramètres de liaison en une seule expérience. Elle ne nécessite aucune modification des partenaires impliqués dans la liaison, que ce soit par marquage fluorescent ou par immobilisation ; l'ITC mesure l'affinité de partenaires de liaison dans leur état natif.
La mesure du transfert thermique durant la liaison permet une détermination précise des constantes de liaison (KD), de la stœchiométrie (n), de l'enthalpie (∆H) et de l'entropie (ΔS) de la réaction. Ceci fournit un profil thermodynamiques complet des paramètres de l'interaction moléculaire. L'ITC va bien au-delà des affinités de liaison et peut permettre d'élucider les mécanismes qui sous-tendent les interactions moléculaires. Cette compréhension profonde des relations structure-fonction fiabilise la prise de décision lors du choix d'un « hit » et de l'optimisation d'un candidat.
La titration calorimétrique isotherme est utilisée pour mesurer les réactions entre les biomolécules. La méthodologie permet une détermination de l'affinité de liaison, de la stœchiométrie, et de l'entropie et de l'enthalpie de la réaction de liaison en solution, sans avoir à recourir à un marquage.
Lorsqu'une liaison s'effectue, la chaleur est absorbée ou libérée. Cette action est mesurée par un calorimètre hypersensible au cours d'une titration graduelle du ligand dans la cellule d'échantillonnage contenant la biomolécule étudiée.

Le microcalorimètre comporte deux cellules, l'une contient de l'eau et sert de cellule de référence, l'autre contient l'échantillon. Le microcalorimètre doit maintenir ces deux cellules à une température rigoureusement égale. Les dispositifs de détection de la chaleur détectent la différence de température entre les cellules lors de la formation de la liaison et fournissent un retour aux dispositifs de chauffage, qui compensent cette différence pour ramener les cellules à la même température.
La cellule de référence et la cellule d'échantillon sont placées à la température voulue pour l'expérience. Le ligand est chargé dans une seringue placée dans un dispositif d'injection extrêmement précis. Le dispositif d'injection est inséré dans la cellule d'échantillon contenant la protéine étudiée. Une série de petits aliquots de ligand est injectée dans la solution de protéine. Si le ligand se lie à la protéine, des variations de chaleur de quelques millionièmes de degré Celsius sont détectées et mesurées.
Lors de la première injection, le microcalorimètre mesure toute la chaleur libérée jusqu'à ce que la réaction de liaison atteigne un équilibre. La quantité de chaleur mesurée est directement proportionnelle au nombre de liaisons.
Dans l'exemple ci-dessous la réaction est exothermique, ce qui signifie que la cellule d'échantillon devient plus chaude que la cellule de référence. Le pic généré est orienté vers le bas. Lorsque la température des deux cellules redevient égale, le signal revient à sa valeur de départ. Le deuxième petit aliquot de ligand est injecté dans la cellule d'échantillon et là encore le microcalorimètre compense la petite variation de chaleur détectée.
Le rapport molaire entre le ligand et la protéine augmente progressivement par une série d'injections de ligand. La protéine est progressivement saturée, le nombre de liaisons avec le ligand diminue et la variation de chaleur commence à décroître jusqu'à ce que finalement la cellule d'échantillon contienne un excès de ligand par rapport à la protéine, la réaction est alors arrivée à la saturation.

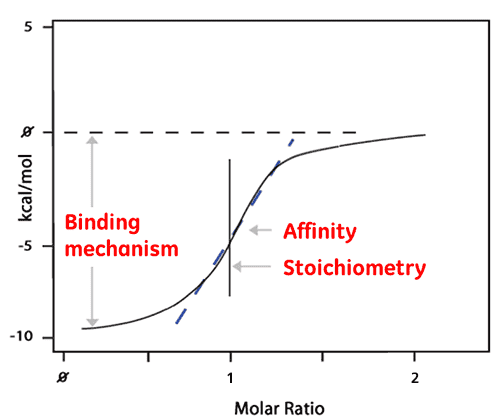
La superficie de chaque pic est ensuite intégrée et tracée en fonction du rapport ligand/protéine. L'isotherme qui en résulte peut être ajustée à un modèle de liaison permettant de déduire l'affinité (KD). Le rapport molaire pris au centre de l'isotherme de liaison donne la stœchiométrie de la réaction. Le tracé représenté ci-dessous montre un exemple de réaction de liaison 1:1.
L'enthalpie (ΔH) est également déduite directement de l'isotherme et est la quantité de chaleur libérée par mole de ligand lié. Il en découle qu'une unique expérience ITC fournit une richesse d'information sur la réaction de liaison, qui aide à comprendre la nature de l'interaction et permet d'en explorer les moteurs thermodynamiques.
L'ITC est largement utilisée pour la recherche et le développement de médicaments, en particulier pour :

PEAQ-ITCMesure à haute sensibilité de tous les paramètres d'une interaction |

MicroCal PEAQ-ITC automatiséMesure à forte productivité de plusieurs paramètres de liaison. |
|
|---|---|---|
| Type de mesure | ||
| Analyse sans marquage | ||
| Affinité de liaison | ||
| Technologie | ||
| Titration Calorimétrique Isotherme (ITC) | ||
| Débit d'échantillon | ||