Une caractérisation fiable de la stabilité des protéines
La Calorimétrie Différentielle à Balayage (DSC) est une technique d'analyse utilisée pour caractériser la stabilité d'une protéine ou d'une autre biomolécule directement sous sa forme native. Cette caractérisation exploite la mesure de la variation de chaleur associée à la dénaturation thermique de la molécule lorsque celle-ci est chauffée à vitesse constante.
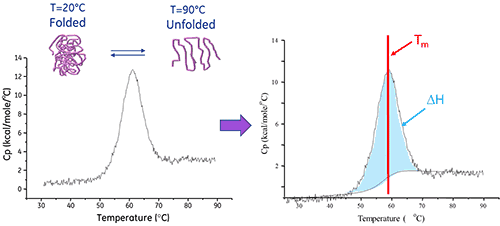
En solution, une biomolécule est en équilibre entre ses conformations native (repliée) et dénaturée (dépliée). Plus la température médiane de transition thermique (Tm) est élevée, plus la molécule est stable. La DSC mesure l'enthalpie (∆H) qui résulte d'un changement de conformation induit par une élévation de température. Elle peut également être utilisée pour déterminer la variation de capacité calorifique (ΔCp) associée à la dénaturation. La DSC permet d'identifier les facteurs contribuant au repliement et à la stabilité des biomolécules natives. Ces facteurs incluent les interactions hydrophobes, les liaisons hydrogène, l'entropie conformationnelle et l'environnement physique.
Les données précises et de haute qualité obtenues par DSC fournissent des informations vitales sur la stabilité des protéines pour le développement d'un procédé ou pour la formulation de candidats thérapeutiques potentiels.
Les macromolécules et les ensembles macromoléculaires (> 5000 Daltons), tels que les protéines, les acides nucléiques et les lipides, peuvent former des structures tridimensionnelles bien définies subissant des changements conformationnels sous l'effet de la chaleur. Ces réarrangements structurels se traduisent par une absorption de chaleur due à la redistribution des liaisons non covalentes. La calorimétrie différentielle à balayage mesure cette absorption de chaleur.
Le calorimètre au cœur d'un système de DSC est constitué de deux cellules, une cellule de référence et une cellule de mesure contenant l'échantillon.
Le dispositif est conçu pour maintenir les deux cellules à la même température, pendant que celles-ci sont chauffées.
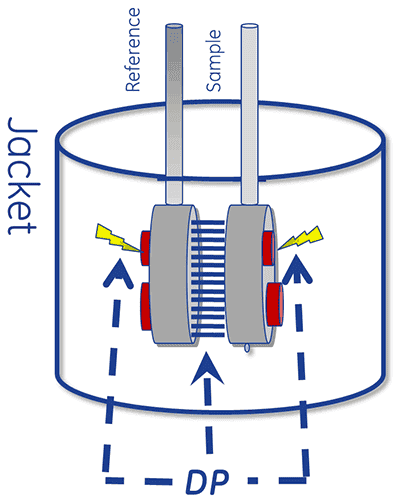
Pour réaliser une mesure de DSC, la cellule de référence est tout d'abord remplie d'un tampon et la cellule de mesure est remplie de la solution échantillon. Ces cellules sont ensuite chauffées à vitesse constante.
L'absorption de chaleur qui accompagne la dénaturation d'une protéine provoque un écart de température (ΔT) entre les cellules, qui conduit à un gradient thermique dans les unités Peltier. Ceci définit une tension, qui est convertie en puissance, laquelle est utilisée pour contrôler l'unité Peltier afin que celle-ci ramène le ΔT (le différentiel de température) à 0 °C. Une autre possibilité consiste à laisser les cellules atteindre un équilibre passif par conduction.
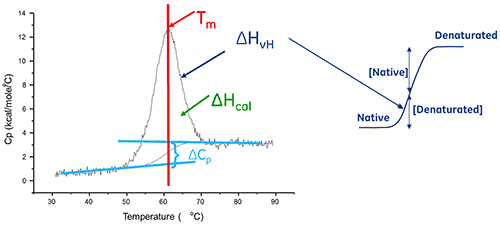
L'enthalpie de dénaturation d'une protéine est la surface sous le pic de DSC normalisé par la concentration et s'exprime en calories (ou Joules) par mole.
Dans certains cas, il est possible d'adapter des modèles thermodynamiques aux données pour en extraire l'énergie libre de Gibbs (ΔG), l'enthalpie calorimétrique (ΔHcal), et l'enthalpie de van't Hoff (ΔHvH), l'entropie (ΔS) et la variation de capacité calorifique (ΔCp) associées à la transition.
La calorimétrie différentielle à balayage est largement utilisée pour la découverte et le développement de médicaments. Les principales applications sont :

Système automatisé MicroCal PEAQ-DSCAnalyse de la stabilité des protéines comme référence absolue pour l’environnement réglementé |

Système MicroCal PEAQ-DSCAnalyse de la stabilité des protéines comme référence absolue pour des applications en recherche |
|
|---|---|---|
| Type de mesure | ||
| Analyse sans marquage | ||
| Stabilité des protéines | ||
| Technologie | ||
| Calorimétrie Différentielle à Balayage (DSC) | ||
| Débit d'échantillon | ||
| Plage de température | ||