
 La conformité réglementaire est essentielle au sein de l'industrie pharmaceutique. Des réglementations sont en place pour s'assurer que seuls des produits sûrs et efficaces, produits d'une manière définie et traçable, parviennent aux consommateurs. Toutefois, se conformer à ces directives peut prendre du temps et représenter une source de stress. Les sociétés pharmaceutiques doivent naviguer dans un système réglementaire complexe, notamment avec les exigences de la norme 21 CFR Part 11, les directives relatives à l'intégrité des données (ALCOA++) et la norme USP <1058>, qui décrit l'ensemble du processus de qualification des instruments analytiques.
La conformité réglementaire est essentielle au sein de l'industrie pharmaceutique. Des réglementations sont en place pour s'assurer que seuls des produits sûrs et efficaces, produits d'une manière définie et traçable, parviennent aux consommateurs. Toutefois, se conformer à ces directives peut prendre du temps et représenter une source de stress. Les sociétés pharmaceutiques doivent naviguer dans un système réglementaire complexe, notamment avec les exigences de la norme 21 CFR Part 11, les directives relatives à l'intégrité des données (ALCOA++) et la norme USP <1058>, qui décrit l'ensemble du processus de qualification des instruments analytiques.
Les règlementations sur les bonnes pratiques (GxP), y compris les exigences relatives aux bonnes pratiques de fabrication (GMP/ICH Q7), en constituent le cadre de référence. Un instrument doit être qualifié selon les spécifications des exigences utilisateur (URS) du client à l'aide des procédures et de la documentation relatives à la qualification d'installation et d'opération (IQ/OQ). Le client doit ensuite effectuer des tests réguliers dans le cadre d'un programme de qualification continue de la performance (PQ).
Quels sont les défis de la conformité ?
Réaliser des mesures dans un environnement validé/réglementé nécessite plus d'attention que jamais. Outre la conformité à la norme 21 CFR Part 11, il est nécessaire de tenir compte de l'intégrité des données des mesures (ALCOA++), y compris le stockage/l'accessibilité à long terme des données, ainsi que de la qualification de l'instrument analytique lui-même. Dans certains cas, le temps nécessaire pour examiner et approuver les mesures peut dépasser le temps de traitement des échantillons. Cette procédure fait partie du cadre indispensable à la mise au point et à la fabrication de produits pharmaceutiques sûrs. Notre logiciel, y compris notre solution OmniTrust, permet (avec une infrastructure informatique locale appropriée) d'assurer la conformité à la norme 21 CFR Part 11 et aux directives relatives à l'intégrité des données ALCOA++. Cette conformité est ensuite mise à l'épreuve par le biais d'audits de surveillance réguliers effectués par les organismes de réglementation appropriés.
En quoi Malvern Panalytical peut-il aider ?
Grâce à nos nombreuses années d'expérience dans le domaine de la qualification des instruments et le développement de logiciels utilisés dans les environnements réglementaires, nous disposons de vastes connaissances dans ce domaine. En plus de fournir des éléments nécessaires tels que des IQ/OQ complets pour nos produits, nous :
- fournissons des normes pour la qualification de la performance (PQ)
- fournissons des scripts de test pour valider la norme 21 CFR Part 11 et l'intégrité des données de votre système
- fournissons un logiciel riche en fonctionnalités qui peut être utilisé dans le cadre d'une solution conforme à la norme 21 CFR Part 11 et/ou aux directives relatives à l'intégrité des données
- pouvons nous renseigner concernant vos besoins personnalisés en matière de validation, vous conseiller sur la qualification pharmaceutique GMP/ICH Q7 et vous aider pour toute question ou exigence supplémentaire
USP <1058> : qualification des instruments analytiques
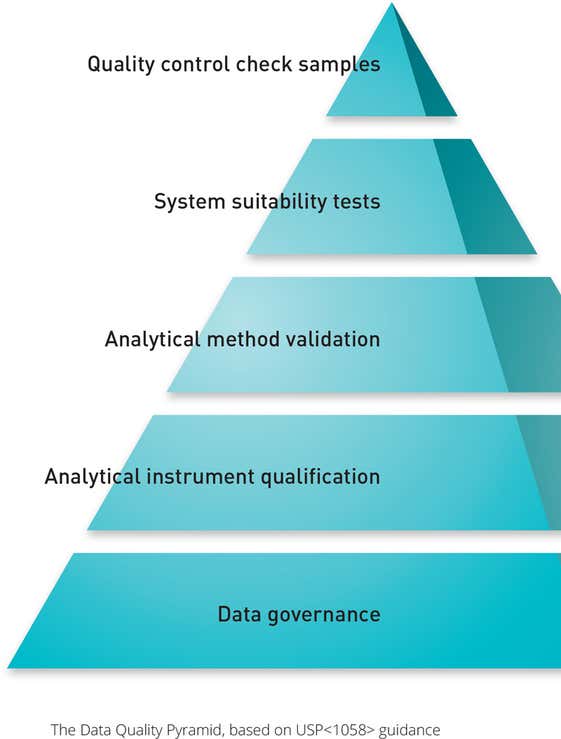
Les exigences détaillées dans la norme USP <1058> ont souligné l'importance de l'IQ/OQ dans le processus de validation. Ces procédures sont désormais directement liées aux spécifications des exigences utilisateur (URS) d'origine d'un instrument, ainsi qu'à la qualification de sa performance (PQ) et à la vérification de sa performance (PV).
La qualification opérationnelle doit également désormais vérifier que l'instrument est adapté à l'application de l'utilisateur final et qu'il fonctionne tel qu'il a été conçu par le fabricant.
Malvern Panalytical propose une solution IQ/OQ complète pour y parvenir, et nous sommes également heureux de vous conseiller sur les exigences de tests supplémentaires.
Logiciel pour les environnements réglementés
L'audit d'une mesure peut prendre du temps. Notre logiciel contient donc de nombreuses fonctionnalités pour rendre ce processus plus efficace pour nos clients. Notre logiciel a été conçu pour être simple mais puissant, ce qui permet de gagner du temps pendant son implémentation et pendant son utilisation quotidienne, de rationaliser le flux de travail et de vous assurer que les audits ne vous réservent pas de mauvaise surprise. Il fait partie d'une solution conforme à la norme 21 CFR Part 11 (associée à une politique informatique robuste).
Les principales fonctionnalités logicielles sont les suivantes :
- définition de rôles fixes pour les utilisateurs
- processus d'approbation pour la signature des mesures
- enregistrement des raisons d'abandon des mesures
- capture des entrées de piste d'audit pour les actions ayant échoué en raison de l'utilisation d'informations d'identification incorrectes
- audit des fonctions de sécurité pour l'affichage à distance
 Téléchargez la brochure OmniTrust : la solution de conformité de Malvern Panalytical pour les environnements réglementés
Téléchargez la brochure OmniTrust : la solution de conformité de Malvern Panalytical pour les environnements réglementés
Services de mise en conformité
Références
Nous fournissons une variété d'étalons de référence et de calibration pour tous vos besoins de validation.
IQ/OQ et scripts de test supplémentaires
Notre équipe de service clients peut exécuter des services IQ/OQ et fournir des scripts de test de validation pour valider la norme 21 CFR Part 11 et les fonctions d'intégrité des données du logiciel.
Services de validation
Nous sommes toujours ouverts aux conversations portant sur les exigences de validation supplémentaires avec nos clients.
Nous fournissons des logiciels, y compris notre solution OmniTrust, pour une utilisation dans les environnements réglementés, qui bénéficient de la mise en place de fonctionnalités telles que les pistes d'audit, les signatures électroniques et l'accès différencié.
Contenu recommandé

Demo at your desk – OmniTrust on Mastersizer 3000; Data integrity solution for the regulated environment
Produits phares
Gamme Mastersizer

Gamme Zetasizer





