La estabilidad de una proteína terapéutica candidata es fundamental en el éxito o el fracaso de su desarrollo. La estabilidad de una proteína tiene impacto en su producción, fabricación, formulación, el almacenamiento a largo plazo, la administración a los pacientes y su eficacia. Las proteínas altamente estables tienden tener menos problemas durante la fabricación, su producción es más rentable y tienen una probabilidad más alta de mantenerse funcionales durante la formulación y el almacenamiento. En el enfoque de calidad basada en el diseño (QbD, por sus siglas en inglés) para el desarrollo biofarmacéutico, la caracterización de la estabilidad es parte de una evaluación inicial de la "capacidad de desarrollo" y la "capacidad de convertirse en fármaco" de una molécula candidata, y se vuelve a examinar constantemente durante el desarrollo del proceso y la fabricación. Los datos de estabilidad también se incorporan en la caracterización e identificación de la estructura de orden superior (HOS, por su sigla en inglés) empleadas como respaldo para la fabricación, la comparabilidad biofarmacéutica y la biosimilitud. La caracterización de HOS de proteínas se está convirtiendo en una inclusión de estándar en las presentaciones regulatorias para nuevos medicamentos biofarmacéuticos y medicamentos biosimilares.
Debido a la naturaleza compleja de las proteínas, las herramientas de caracterización biofísica son importantes en el análisis de un producto biofarmacéutico. Existe una variedad de herramientas biofísicas que se usan de manera habitual para evaluar la estabilidad de las proteínas, incluidos el (pero no limitado a) dicroismo circular (CD, por sus siglas en inglés), la dispersión de luz dinámica (DLS) y estática (SLS), la cromatografía por exclusión de tamaño-dispersión de luz multiangular (SEC-MALS, por sus siglas en inglés), la espectroscopía infrarroja transformada de Fourier (FTIR, por sus siglas en inglés), la ultrafiltración de análisis (AUC, por sus siglas en inglés), cromatografía por exclusión de tamaño (SEC), fluorescencia de barrido diferencial (DSF), fluorescencia intrínseca (IF, por sus siglas en inglés) y calorimetría de barrido diferencial (DSC, por sus siglas en inglés).
Si bien todas estas tecnologías desempeñan un papel importante en el desarrollo biofarmacéutico, la caracterización de la estabilidad térmica por medio de la DSC es fundamental. En una artículo publicado en 2015 sobre las técnicas biofísicas utilizadas para la caracterización de estructuras de orden superior de anticuerpos monoclonales, Gokarn et al. afirmaron: "la DSC sigue siendo una técnica inigualable para evaluar la estabilidad termodinámica de proteínas en una condición de solución amortiguadora determinada"[1].
Este documento se enfoca en el uso de la DSC para caracterizar la estabilidad térmica de productos biofarmacéuticos de base proteica (principalmente anticuerpos) durante el desarrollo de preformulaciones y formulaciones, con el fin de elegir las condiciones de solución en las que la proteína está preferentemente en su conformación nativa plegada, de modo que se pueda producir un medicamento estable y eficaz.
La DSC es una técnica de microcalorimetría que se emplea para caracterizar la estabilidad térmica y conformacional de proteínas, ácidos nucleicos, lípidos y otros biopolímeros [2-7]. La DSC mide la capacidad térmica como una función de temperatura. Los instrumentos de DSC empleados para la caracterización de proteínas que se describen en este documento son instrumentos de "compensación de energía", con una celda fija para muestras, que contiene el biopolímero en una solución amortiguadora, y una celda de referencia compatible llenada con la misma solución amortiguadora. La señal de capacidad térmica (Cp) de la celda para muestras se compara con la de la celda de referencia. A medida que aumenta la temperatura de las celdas, las diferencias de temperatura entre la celda de referencia y la celda para muestras se miden y calibran continuamente respecto de las unidades de energía. La DSC se conoce como "un ensayo de degradación forzada", ya que la proteína se expone a una temperatura en aumento y comienza a desplegarse, y la Cp de la proteína aumenta de manera proporcional (Figura 1).
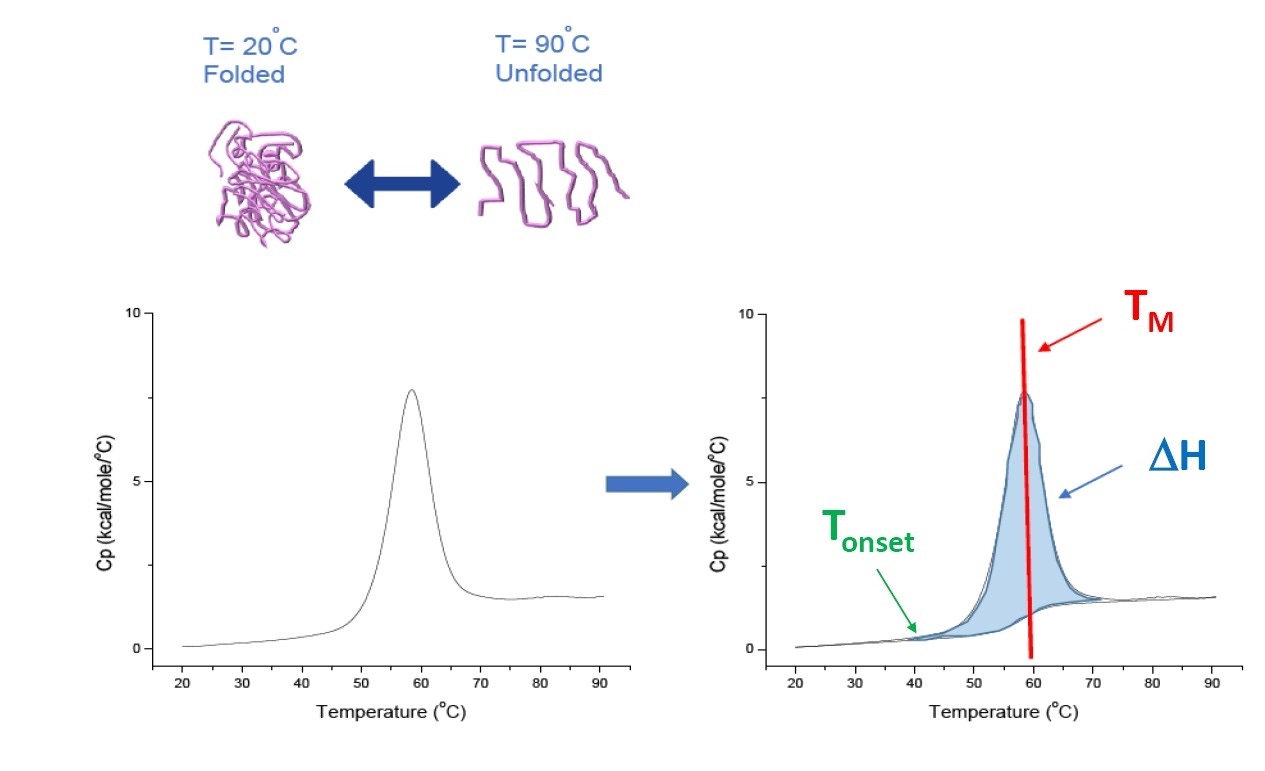
Figura 1: cómo funciona la DSC: la capacidad térmica (Cp) cambia a medida que la proteína se desnaturaliza térmicamente. El experimento de DSC comienza con una temperatura a la cual la proteína está inicialmente plegada en su conformación nativa. Con el aumento de la temperatura, en algún punto la proteína comenzará a desplegarse o desnaturalizarse (Tde inicio) y la Cp aumenta. En la temperatura a la cual el 50% de la proteína está en su conformación nativa y el otro 50% está desnaturalizado, la Cp alcanzará su valor máximo. Este valor es el punto medio de transición térmica o TM. Por sobre el TM, la proteína estará mayormente desnaturalizada y, al final del experimento de DSC, toda la proteína estará en su conformación desplegada. Los parámetros experimentales para la DSC incluyen la Tde inicio, el TM y la entalpía de despliegue (ΔH).
La DSC mide directamente el cambio de la capacidad térmica, sin necesidad de usar fluorescencia o cualquier otro marcador o sonda. Para las proteínas que se desnaturalizan de manera reversa, el punto medio de transición térmica (TM), también llamado temperatura de fusión o desnaturalización, es la temperatura a la cual la proteína se encuentra en equilibrio conformacional, con el 50% en su conformación nativa (plegada) y el otro 50% en su conformación desnaturalizada. El TM se observa como el "pico" en un termograma de DSC.
El TM se considera un buen indicador de la estabilidad térmica: mientras más alto el TM, más térmicamente estable es la proteína. Las proteínas multidominio (como los anticuerpos) habitualmente arrojan más de un pico en un termograma de DSC, de modo que se puede determinar más de un TM (consulte la Figura 2 para ver un ejemplo).
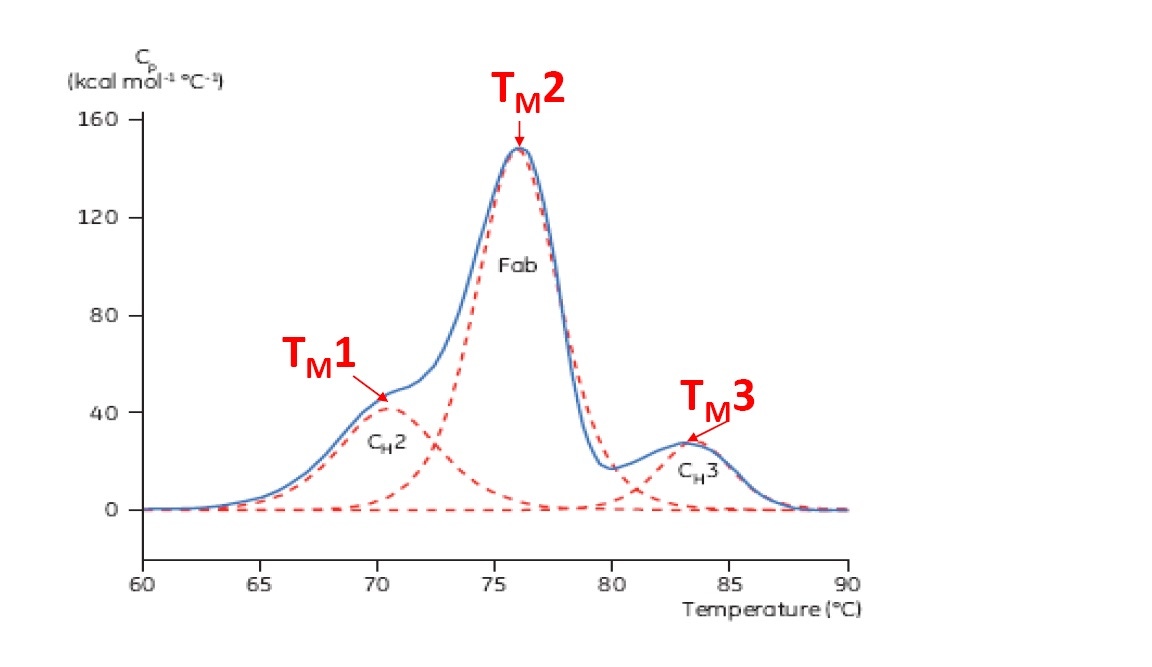
Figura 2: termograma de DSC representativo de un anticuerpo monoclonal con dominios identificados de CH2, fragmento de unión a los antígenos y CH3 Las líneas rojas discontinuas son picos deconvolucionados de cada transición de dominio con los tres TM indicados.
La DSC proporciona otros parámetros útiles que se pueden emplear para caracterizar y ordenar la estabilidad de las proteínas, incluida la entalpía de despliegue (ΔH), que se mide por el área bajo la curva. El despliegue de proteínas es un proceso endotérmico, ya que se necesita aplicar energía para romper los enlaces secundarios no covalentes que mantienen a la proteína correctamente plegada. La DSC también determina la Tde inicio (comienzo del despliegue), la ΔCp (cambio de la capacidad térmica de despliegue) y la T1/2 (amplitud en la mitad de la altura del pico, muestra de la forma del termograma de despliegue). El análisis de DSC puede incluir la determinación de cualquier combinación de estos parámetros.
La mayoría de las proteínas se desnaturalizan de manera irreversible y tienden a agregarse o precipitar cuando se calientan. El TM y otros parámetros derivados del análisis de DSC de proteínas con desnaturalización irreversible no son parámetros termodinámicos verdaderos. Sin embargo, el orden de los TM del análisis de DSC de proteínas con desnaturalización irreversible es un parámetro cualitativo muy útil para las pruebas de estabilidad.
Malvern Instruments ofrece el sistema MicroCal VP-Capillary DSC [8,9], que corresponde una calorimetría de barrido diferencial automatizada, diseñada para la detección de TM y la caracterización termodinámica de proteínas y biopolímeros en solución.
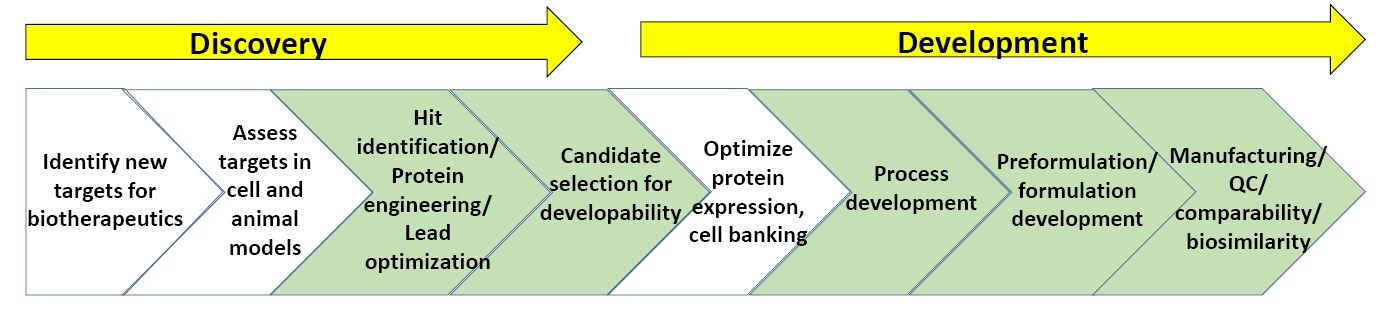
Figura 3. Esquema general de los procesos en el descubrimiento y desarrollo biofarmacéutico
La Figura 3 muestra un esquema generalizado del descubrimiento biofarmacéutico y el proceso de desarrollo. Las secciones en verde destacan los puntos en los cuales se utiliza de manera más habitual la caracterización biofísica, incluido el ensayo de estabilidad (para conocer más detalles, al final de este documento hay una lista de "lecturas sugeridas" sobre el descubrimiento y el desarrollo biofarmacéutico).
La secuencia de aminoácidos que crea una cadena polipeptídica se conoce como la estructura primaria de la proteína (1°). Además de esto, existen 3 niveles adicionales de estructura de orden superior (HOS), lo que es importante caracterizar para comprender completamente la estabilidad, la funcionalidad, la actividad y la naturaleza general de la proteína. La estructura secundaria de una proteína (2°) hace referencia a los patrones de plegado locales de la estructura primaria de una proteína, incluidas las hélices alfa, las láminas beta, los giros y los espirales al azar. La estructura terciaria (3°) se refiere a la estructura tridimensional final de una proteína, que surge de un espectro de elementos de estructura secundaria. Por último, la estructura cuaterniaria (4°) describe los resultados de la interacción de dos o más cadenas polipeptídicas idénticas o diferentes.
El medio más común de administración de bioterapéuticos es a través de la vía subcutánea (SC). Los medicamentos de base proteica administrados por vía subcutánea deben ser estables y no se deben ver afectados con altas concentraciones de proteína (sobre 100 mg/mL) dentro de los cierres de su envase, (por ejemplo, ampollas o jeringa llenada previamente), generalmente por varios años. Considerando esto, para crear un producto biofarmacéutico apropiado, los científicos primero buscan biomoléculas que ya demuestren una alta estabilidad durante la etapa de selección de candidatos. Sin embargo, a lo largo de proceso de desarrollo y fabricación, hay muchos factores que pueden afectar la estabilidad de una molécula, lo que significa que puede que sea necesario introducir una estabilidad mayor por medio de la ingeniería de proteínas.
El proceso de purificación implica aislar la proteína de condiciones donde está estable, correctamente plegada y activa, de manera que es importante adaptar cuidadosamente las soluciones amortiguadoras, los aditivos, los métodos de purificación y las condiciones de almacenamiento para mantener la proteína lo más estable posible en este punto. Cuando las moléculas de proteína están expuestas a agentes de estrés como el calor, químicos, cambios de pH, presión, mezcla y alta concentración, que con frecuencia ocurren durante la formulación y la producción biofarmacéutica, su conformación puede favorecer la forma desnaturalizada (desplegada).
Las proteínas en solución también son susceptibles a modificaciones como la desamidación y la oxidación, que pueden generar proteínas desnaturalizadas e inactivas. En el caso de los productos biofarmacéuticos de base proteica, la desnaturalización u otras modificaciones podrían generar la formación de agregados que provocan que los productos tengan una eficacia reducida o se vuelvan no funcionales como medicamentos. Quizás más importante, existe creciente evidencia que apunta al papel que puede desempeñar la agregación de proteínas en la generación de reacciones inmunogénicas no deseadas y potencialmente fatales para los pacientes. El uso de proteínas inherentemente estables genera una producción más rentable y permite crear medicamentos más satisfactorios, eficaces y seguros.
La DSC proporciona una descripción general de la estabilidad y los cambios conformacionales en la estructura terciaria y cuaternaria que se producen cuando una proteína se desnaturaliza térmicamente, así como la información sobre cómo los factores intrínsecos y extrínsecos pueden afectar la estabilidad de la proteína. La DSC es considerada el mejor ensayo y el más cuantitativo para la caracterización de la estabilidad térmica de proteínas biofarmacéuticas y, generalmente, se usa para predecir la estabilidad a largo plazo[1,10-14]. Los TM generados con el uso de la DSC son un parámetro que se emplea frecuentemente para ordenar la estabilidad durante la selección de candidatos (capacidad de desarrollo), las pruebas de formulación y el desarrollo del proceso. La entalpía (ΔH), la Tde inicio, la T1/2 y la ΔCp a partir de la DSC también se usan para ordenar la estabilidad, la validación de los datos de DSC, el análisis cuantitativo del despliegue de proteínas y la identificación de estructuras de orden superior[10-14].
Los análisis de DSC para proteínas altamente similares en condiciones de solución definidas son reproducibles y cuantitativos (Figura 4). Es decir, los termogramas de DSC tendrán un perfil similar y los parámetros (incluidas los TM, la ΔH y la Tde inicio) estarán dentro de un rango aceptado[12-14]. Si los termogramas parecen ser diferentes y los parámetros de ajuste de DSC cambian, esto sugiere que han ocurrido eventos como el pliegue incorrecto de la proteína, degradación, agregación, diferencias en la solución amortiguadora, cambios en la modificación postraduccional u otro cambio de estructura de orden superior, lo cual tiene un impacto en la estabilidad conformacional de la proteína.
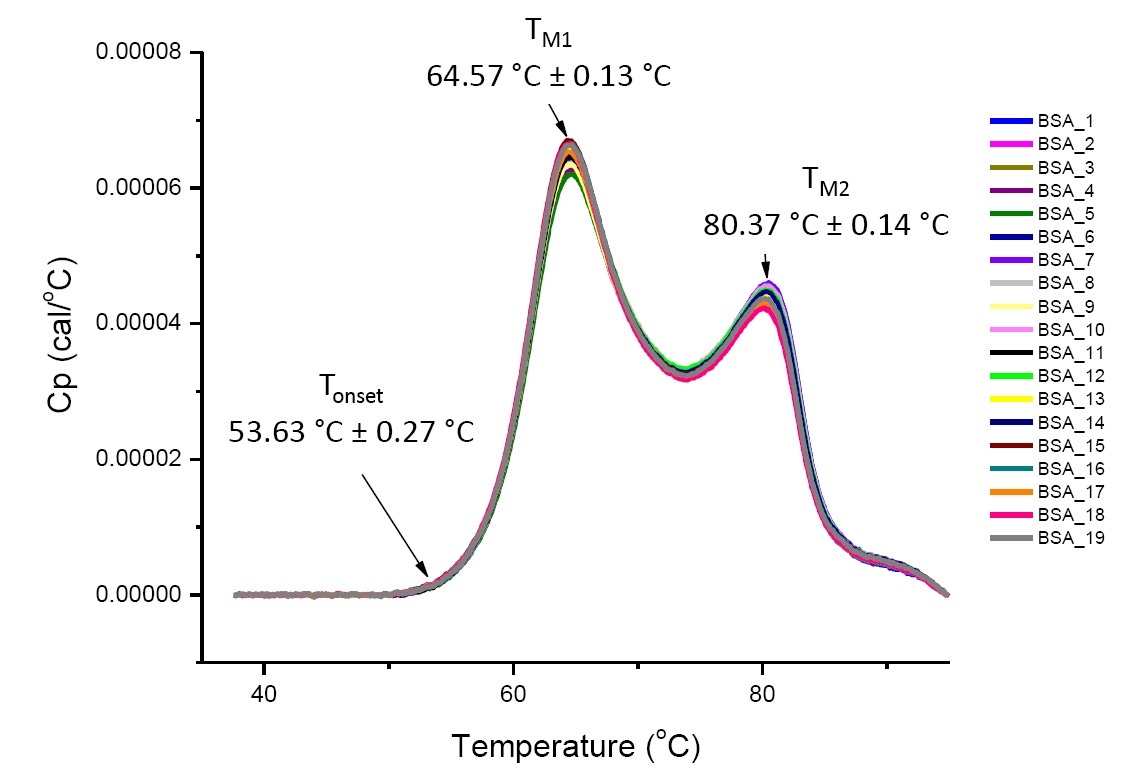
Figura 4: 19 termogramas de DSC de albúmina sérica bovina (Sigma A1933, purificado por cromatografía) en un tampón fosfato salino (PBS, por su sigla en inglés) Datos de DSC mostrados después de la normalización de la tasa de barrido, la sustracción buffer-buffer y sustracción de integración y línea de base Se muestran las desviaciones media y estándar de la Tde inicio, el TM1 y el TM2.
Los resultados reproducibles y cuantitativos hacen de la DSC una herramienta de caracterización de HOS valiosa para la evaluación de productos durante la fabricación (incluidas la comparabilidad de lote con lote y sitio con sitio), la comparación de variantes de proteína y productos modificados (incluidos los cambios estructurales debido a glicosilación, desamidación y oxidación) y biosimilitud. Los datos de DSC también se usan en documentos regulatorios de respaldo como parte de la caracterización de HOS para nuevas presentaciones de medicamentos y biosimilares. En una encuesta realizada a científicos del área biofarmacéutica, la DSC fue calificada como una técnica de análisis biofísico "muy útil" a "extremadamente útil" durante la selección de candidatos, el desarrollo de formulaciones, la caracterización del producto, la comparabilidad y la biosimilitud[15].
Los valores de TM se pueden determinar de manera muy sencilla a partir de los picos del termograma de DSC, sin necesidad de realizar un análisis de datos complejo. Como ya se ha mostrado (Figura 2), para las proteínas multidominio como los anticuerpos, los termogramas de DSC muestran más de una transición de despliegue. Con la DSC se pueden caracterizar y cuantificar los diferentes dominios y se pueden determinar los TM para dos, tres o más transiciones. Otros ensayos biofísicos que pueden determinar el TM, como el CD, la IF y la DSF, pueden detectar solo el primer TM (que ocurre a la temperatura más baja), o el TM más "dominante" para proteínas multidominio. La extracción de más de un TM de datos espectroscópicos o fluorescentes requiere del ajuste de datos complejos y es posible que no sea reproducible.
En comparación con otros ensayos de detección del TM, la DSC requiere generalmente más muestra de proteína por barrido y puede presentar un menor desempeño. Si la muestra es limitada, una opción sería realizar un orden inicial del TM, ya sea con DSF o IF, y luego seleccionar varias muestras clave para validar el TM con DSC. Es importante que se lleve a cabo el paso de validación de esta DSC y que no se considere la fluorescencia o la espectroscopía por sí solas para la medición del TM en ensayos de estabilidad. Los ensayos basados en fluorescencia generalmente experimentan errores que interfieren con las mediciones, lo que cambia los resultados del TM a un valor superior (o inferior). Además, algunas proteínas y condiciones de solución amortiguadora no son compatibles con la fluorescencia, lo que hace que tanto la DSF como la IF sean inapropiadas. Por último, la fluorescencia y la espectroscopía no poseen la capacidad para determinar la entalpía calorimétrica y otros parámetros termodinámicos que entrega la DSC.
Los investigadores en la industria biofarmacéutica consideran la DSC como el ensayo de estabilidad térmica de referencia, ya que la técnica:
Mide los cambios de calor asociados al despliegue de la proteína.
Es una medición directa del despliegue de la proteína, de modo que no se necesitan marcadores, sondas o etiquetas (como consecuencia, la DSC no se ve afectada por errores de detección potenciales comunes en ensayos de fluorescencia o espectroscopía).
Es aplicable a proteínas nativas en solución.
Se puede utilizar con prácticamente todas las soluciones amortiguadoras y aditivos en uso común para la purificación y la formulación biofarmacéutica. En contraste, muchas de estas soluciones amortiguadoras y aditivos son incompatibles con la fluorescencia y la espectroscopía.
Es fácil de configurar y operar.
Tiene un control de temperatura de alta precisión, con un rango de operación de hasta 130 °C, que permite detectar la mayoría de las transiciones de TM alto. La mayoría de los otros ensayos de detección de TM calientan las muestras solo hasta 100 °C (o incluso menos).
Es un ensayo de degradación forzada y no requiere el almacenamiento de la proteína en soluciones amortiguadoras calentadas antes del análisis.
Tiene una salida de datos simple y un software de análisis de datos integrado.
Se puede utilizar para resolver transiciones de despliegue por separado y caracterizar proteínas multidominio y proteínas complejas, así como proteínas de un dominio simples.
Proporciona una gran cantidad de información y entrega información termodinámica, además de la estabilidad conformacional y la determinación del TM.
Se puede utilizar como un ensayo primario para la caracterización de la estabilidad térmica bioterapéutica y también se puede usar con otras herramientas de pruebas biofísicas ortogonales/complementarias, o validar otros datos.
Está disponible con automatización de alto rendimiento (sistema MicroCal VP-Capillary DSC) para la detección rápida de la estabilidad térmica.
Ya que se trata de transiciones de medicamentos de base proteica a través del proceso de descubrimiento y desarrollo, es importante desarrollar una formulación apropiada, efectiva y óptima que mantenga la estabilidad, la conformación y la eficacia durante la administración, el uso y el tiempo completo de la vida útil deseada del producto. La formulación debe ser rentable para la fabricación. Existe una preferencia por formulaciones de proteínas que se pueden autoadministrar para conveniencia del paciente, que requieren que el medicamento se entregue y se almacene en una jeringa llenada previamente o un sistema de entrega similar que no necesite la ayuda de un profesional médico. Además, el medicamento se debe almacenar a temperatura ambiente o en un refrigerador. Algunos productos biofarmacéuticos también se pueden entregar liofilizados (deshidratado por congelación), lo cual requiere que el medicamento se solubilice antes de su administración.
En la etapa inicial del ciclo de desarrollo, el volumen de muestra disponible para la prueba es generalmente limitado, de modo que algunas empresas realizan el desarrollo de preformulaciones, que incluye estudios biofísicos iniciales a pequeña escala para definir la composición óptima de la solución amortiguadora y el pH apropiado para ayudar a estabilizar la proteína. Este trabajo ayuda a estabilizar la formulación que probablemente se usará para pasar el medicamento con proteínas a pruebas preclínicas o clínicas. El desarrollo de preformulaciones se puede realizar al mismo tiempo que la selección de candidatos para la evaluación de la capacidad de desarrollo del medicamento, ya que muchas de las mismas pruebas biofísicas están incluidas en ambos conjuntos de evaluaciones.
Durante el desarrollo de preformulaciones y el desarrollo de formulaciones posterior de un medicamento de base proteica, la proteína está expuesta a diferentes condiciones que incluyen:
Diferentes soluciones amortiguadoras, niveles de pH y concentraciones salinas
Diferentes aditivos de formulación (excipientes) Los excipientes son materiales inertes presentes en formulaciones líquidas y liofilizadas para ayudar a estabilizar la proteína o ayudar en la fabricación o la entrega del medicamento. Los excipientes que generalmente se usan para productos biofarmacéuticos incluyen surfactantes (por ejemplo, polisorbato 80), azúcares (por ejemplo, trehalosa), polioles (por ejemplo, glicerol), aminoácidos, conservantes y antioxidantes.
Es posible que se generen altas concentraciones de proteína para medir los niveles a los cuales el candidato a medicamento se puede concentrar (en un rango de soluciones amortiguadoras y aditivos) antes de que se produzca la agregación de proteínas.
Extremos de temperatura, presión y humedad
Ciclos repetidos de congelamiento/derretimiento y agitación (por ejemplo, en presencia de interfaces de aire o líquido, estrés por transporte)
Contacto con una variedad de superficies de diferentes materiales, incluidos ejemplos de cierres de contenedores finales (por ejemplo, ampollas, jeringas llenadas previamente, envases de soluciones intravenosas)
Diferentes niveles de luz
Oxidantes
Pruebas de almacenamiento en tiempo real (para evaluar el potencial de estabilidad a largo plazo del medicamento por medio de su conservación en condiciones de almacenamiento previstas a lo largo de una vida útil típica de dos años) y estudios de estrés acelerado a temperaturas elevadas
En un artículo publicado en 2016 por Kang et al.[16] se evaluaron 36 formulaciones que se usaron satisfactoriamente para anticuerpos monoclonales comerciales. El resumen de la evaluación constató:
12 fueron formulaciones y 25 correspondieron a formulaciones líquidas (concentraciones que iban de 2 mg/mL a 200 mg/mL).
Los excipientes incluyeron: sales, surfactantes, polioles, disacáridos polisacáridos, aminoácidos y antioxidantes.
Normalmente, se usaron soluciones amortiguadoras de acetato, citrato, histidina, fosfato y Tris para mantener un pH óptimo entre 4,7 y 7,4.
La mayoría de las formulaciones usaron uno de tres surfactantes comunes: polisorbato 80 (Tween 80), polisorbato 20 (Tween 20) y poloxámero 188.
Todas las formulaciones liofilizadas incluyeron azúcares (polioles/disacáridos/polisacáridos), mientras que el 30% de las formulaciones líquidas incluyeron azúcares.
Con frecuencia se usó NaCl.
La glicina y la arginina fueron excipientes aminoácidos usados comúnmente.
Una proteína en solución acuosa está en equilibrio entre sus conformaciones nativa (plegada) y desnaturalizada (desplegada). Las interacciones hidrófobas y los enlaces de hidrógeno son fuerzas de estabilización importantes de las proteínas y se deben superar para desplegar o desnaturalizar la molécula. La entropía conformacional debilita estas fuerzas estabilizadoras, lo que permite el despliegue de la proteína. En el desarrollo de formulaciones, el objetivo principal es encontrar las condiciones de solución que proporcionen el nivel más alto de estabilización y, con esto, permitir la más alta proporción de proteína nativa. Las proteínas desnaturalizadas tienden a ser más susceptibles a procesos químicos irreversibles como la proteólisis, la oxidación y la desamidación, que pueden, a su vez, provocar la inactivación o la agregación.
Las herramientas de caracterización biofísica se usan para monitorear la conformación de las proteínas, predecir la estabilidad térmica y medir la formación de agregación en respuesta las condiciones de formulación y almacenamiento. Muchas de las herramientas biofísicas que se describen en secciones anteriores de este documento se incluyen en el flujo de trabajo del desarrollo de preformulaciones y formulaciones. Estas incluyen DSC, DSF, DLS, SLS, CD e IF. Estos ensayos evalúan la estabilidad de conformación de la proteína (mediante la determinación del TM, la Tde inicio, el perfil del termograma de DSC), HOS, el tamaño de partícula y la formación de agregación.
Por lo general, el orden del TM por medio de la DSC se usa como una prueba inicial del pH de la formulación, las soluciones amortiguadoras y los excipientes. Normalmente, mientras más alto es el TM medido, más estable es la proteína en la formulación (consulte la Figura 5 para conocer termogramas de DSC durante la prueba de pH de una proteína), y menos probable es que se genere una formación de agregación durante el almacenamiento (consulte los estudios de caso más abajo). La DSC es compatible con casi todas las soluciones amortiguadoras y excipientes usados en formulaciones biofarmacéuticas. Incluso si las transiciones térmicas de una proteína son irreversibles por naturaleza, la DSC es un método conveniente y rápido para ordenar el efecto de las condiciones de soluciones amortiguadoras y excipientes en la estabilidad de proteínas a lo largo del desarrollo de formulaciones.
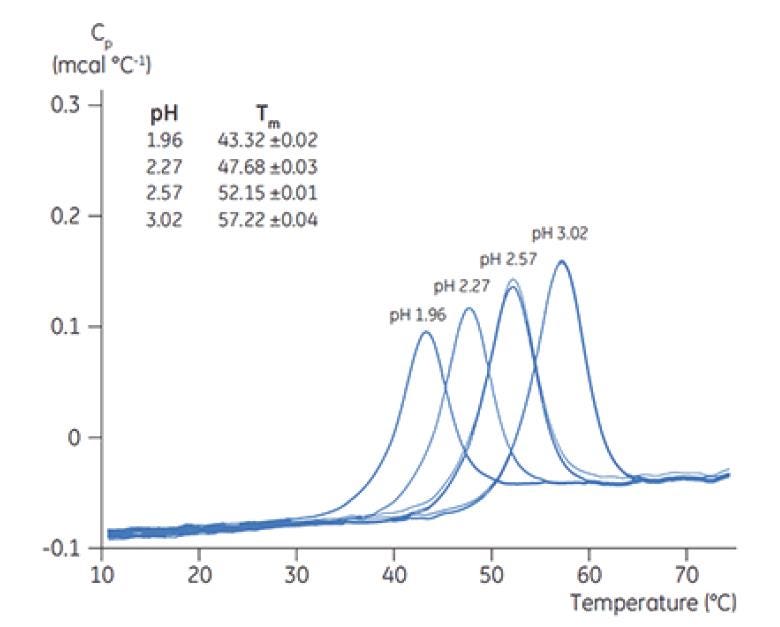
Figura 5. Termogramas de DSC de quimotripsinógeno con diferentes valores de pH, con el TM indicado para cada pH.
Los sistemas MicroCal VP-Capillary DSC se utilizan en un gran número de organizaciones de desarrollo por contrato (CMO, por su sigla en inglés) y organizaciones de desarrollo y fabricación por contrato (CDMO, por su sigla en inglés) para la caracterización de la estabilidad conformacional y el desarrollo de formulaciones de productos biofarmacéuticos. Entre estas empresas se encuentran Patheon[16], Fujifilm Diosynth Biotechnologies[17] y KBI Biopharma[18].
Los estudios de estabilidad acelerados (o "pruebas de estrés") son un elemento común en las pruebas de formulación e implican el almacenamiento de la molécula candidata en una gama de diferentes formulaciones potenciales a temperaturas elevadas. También involucran la evaluación de estas formulaciones por un tiempo para analizar la estabilidad conformacional, el tamaño, la agregación y las modificaciones postraduccionales potenciales con el uso de SEC, DSC y DLS.
Una vez que el producto biofarmacéutico candidato avanza en el proceso de desarrollo y hay una cantidad suficiente de proteína disponible, la caracterización cambia su foco a los procesos involucrados en la formulación final y la producción, así como los potenciales efectos de la concentración de proteínas y los dispositivos de dosificación. Los estudios de estabilidad a largo plazo también se realizan para demostrar que el medicamento de base proteica en la formulación seleccionada tiene la vida útil y la estabilidad deseadas. Una buena formulación mantendrá el perfil de HOS del producto biofarmacéutico por al menos dos años.
Aunque no hay certeza absoluta de que la estabilidad térmica siempre estará relacionada con la estabilidad física de una proteína durante el almacenamiento, un TM más alto habitualmente sí es una muestra de que se requiere más energía para desplegar una proteína. Cuando todas las otras propiedades de la proteína son similares, las formulaciones de las proteínas que permiten una mejor estabilidad térmica son más apropiadas.
En una publicación de 1998 realizada por Remmele et al.[19], se utilizó MicroCal DSC para caracterizar la estabilidad térmica del receptor de interleucina-1 recombinante humana tipo 1 (IL-1R) en soluciones amortiguadoras que incluyen diferentes excipientes. Un estudio de estabilidad acelerado (a 30 °C y 50 °C) en el que se usó IL-1R almacenado en soluciones con pH de 3 a 9 mostró una descomposición y agregación mínimas de proteínas en el pH 6 (por medio de electroforesis en gel de poliacrilamida con dodecilsulfato sódico [SDS-PAGE]). El termograma de DSC para IL-1R en la solución control (20 mM de citrato sódico con pH 6,0) mostró el primer TM a 48 °C y el segundo TM a 65,5 °C. Se examinaron 23 excipientes diferentes, incluidos azúcares (manitol, lactosa, sacarosa y glucosa), polioles (polietilenglicol, glicerol y etanol), surfactantes (Tween 80, Pluronic F68), sales (NaCl y CaCl2) y aminoácidos (lisina, cisteína, alanina, arginina, glicina). El segundo TM no se vio afectado por los excipientes, de modo que la temperatura de la primera transición térmica se usó para ordenar la estabilidad. La estrategia fue buscar excipientes que elevaran el TM de la transición a baja temperatura, lo que indicó un cambio positivo en la estabilidad de la proteína nativa. La mayoría de los excipientes examinados mostraron un cambio descendente en el TM (lo que sugirió una desestabilización de la IL-1R) o un pequeño cambio ascendente. El aditivo que generó el cambio ascendente más significativo en el TM y que indicó una estabilidad conformacional mejorada, fue 100 mM de NaCl, que llevó el primer TM de 48,1 °C a 53,1 °C. Los autores trataron de aumentar las concentraciones de NaCl de 100 mM a 1500 mM y se siguió observando un aumento del TM. A partir de estos resultados, los autores dedujeron que la estabilidad térmica adicional de la IL-1R en presencia de NaCl se debió a las interacciones directas de NaCl con la proteína y posiblemente a los cambios en la estructura del agua. Se realizaron análisis de excipientes adicionales en presencia de 100 mM de NaCl.
En este mismo estudio, los autores observaron el efecto que tienen los conservantes en la estabilidad y la agregación de la IL-1R. Se incluyeron conservantes en formulaciones multidosis. Con alcohol bencílico, m-cresol y fenol, los termogramas de DSC mostraron que los tres conservantes desestabilizaron la IL-1R, donde el fenol tuvo el menor efecto en la estabilidad térmica y el alcohol bencílico, el efecto desestabilizador más significativo en los TM. Estos resultados se verificaron con un análisis SEC de formación de agregación luego de 7 y 60 días de almacenamiento a 37 °C. Las muestras con fenol mostraron el nivel más bajo de agregación, mientras que aquellas que se incubaron con alcohol bencílico mostraron el nivel más alto de agregación.
Remmele y Gombotz[20] demostraron que la medición del TM con DSC es un buen indicador para predecir la agregación de CD40L. En una prueba de estabilidad de pH con DSC, los TM más altos se midieron entre el pH 6 y pH 7,5, que se correlacionan con el rango de pH que mostró el porcentaje más bajo de formación de agregación, según lo medido con SEC (luego de un almacenamiento a 37 °C por 7 días).
Remmele[11] resume otros estudios que utilizan datos de termogramas de DSC para predecir y ordenar la estabilidad de proteínas (por ejemplo, quimotripsinógeno y pepsinógeno) en una variedad de formulaciones. Remmele también discute cómo el uso de DSC junto con otras técnicas de análisis (SEC-HPLC, CD, AUC, DLS, MS) puede entregar detalles sobre la estabilidad conformacional de un producto biofarmacéutico en diferentes formulaciones. Esta información se puede utilizar para tomar decisiones acerca de qué formulación avanzará en el proceso.
Otros estudios de pruebas de formulación concuerdan en que las formulaciones con altos valores de TM (según lo medido con DSC) tienden a mostrar niveles más bajos de agregación cuando se analizaron en estudios de estabilidad acelerados y SEC-HPLC[21-25].
Burton et al.[26] evaluaron el uso de la DSC como una herramienta de prueba rápida para evaluar la estabilidad de anticuerpos recombinantes de dos modelos. Los cambios en el TM se monitorearon como una función de pH o excipientes y los resultados se compararon con los datos de estabilidad acelerada de muestras analizadas con SEC. Los datos generados con MicroCal DSC se correlacionaron con aquellos obtenidos con SEC (las muestras con valores más altos de TM medidos con DSC también mostraron los niveles más bajos de agregación medidos con SEC), de modo que con DSC se pudo determinar el pH óptimo para la solución y los efectos de excipientes en la estabilidad de la solución. Los valores de pH en los que se predijeron los valores máximos de estabilidad por medio de DSC fueron pH 7,5 para la Proteína I y pH6 para la Proteína II. Estos valores coincidieron con las predicciones obtenidas de estudios de estabilidad a largo plazo de soluciones para cada proteína. Para citar a los autores en la conclusión del artículo, "los resultados de estos estudios sugieren que la microcalorimetría puede ser una herramienta útil para analizar rápidamente la estabilidad de proteínas en solución, especialmente en la fase inicial de la caracterización de la proteína y el desarrollo de formulaciones cuando los suministros de volúmenes son, con frecuencia, limitados. Esto puede generar ahorros potenciales significativos en términos de requisitos de sustancias de medicamentos y tiempo y esfuerzo empleados en la preparación de muestras y el análisis complejo de las muestras." [26]
Una nota de aplicación de Malvern destaca cómo la Dra. Katherine Bowers (Fujifilm Diosynth Biotecnologías) utiliza DSC en el desarrollo de preformulaciones[27]. El anticuerpo X se colocó en una gama de soluciones amortiguadoras desde el pH 3 a pH 8, se realizó inmediatamente el análisis de DSC (usando MicroCal VP-Capillary DSC) (T=0) y se llevó a cabo el almacenamiento por una semana.
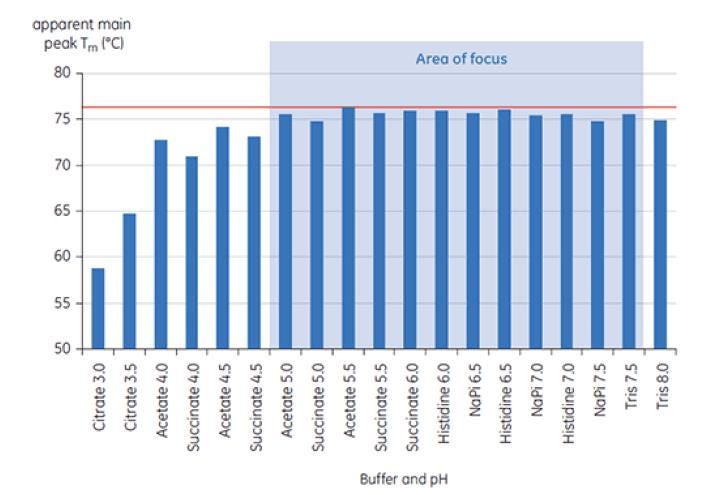
Figura 6: rango de valores de TM para el anticuerpo X en soluciones amortiguadoras de preformulaciones Las muestras se analizaron usando MicroCal VP-Capillary DSC a T=0.
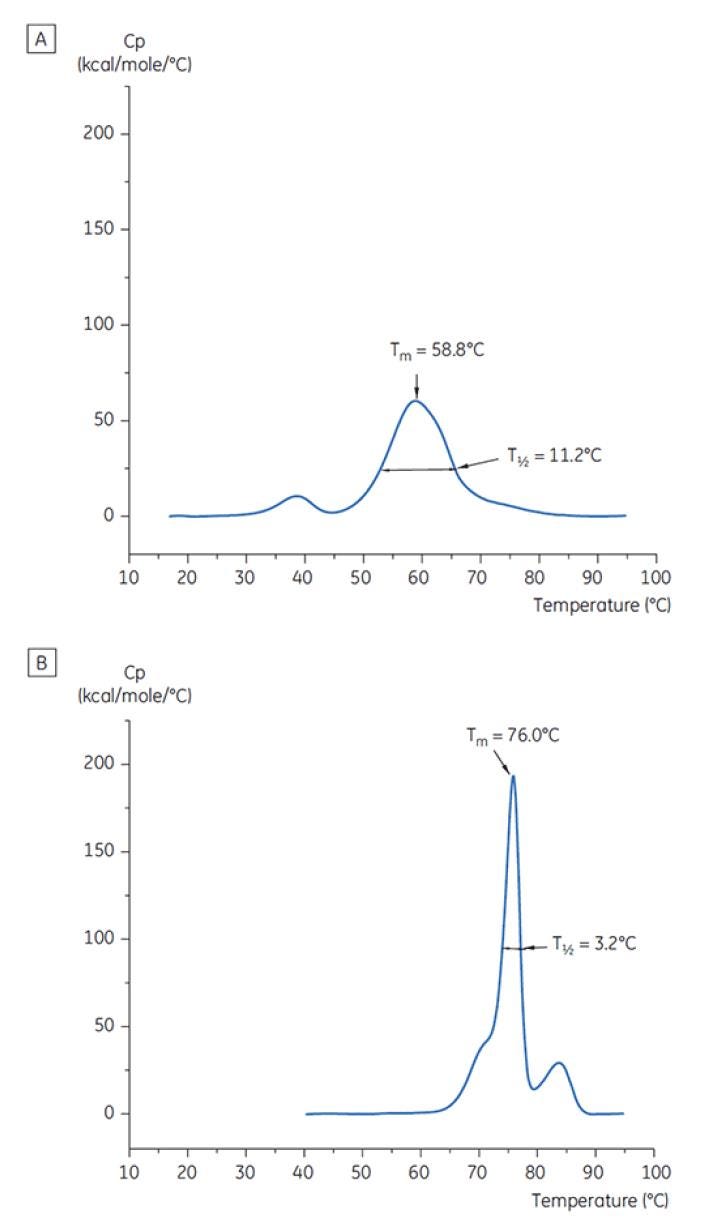
Figura 7: termogramas de DSC del anticuerpo X a T=0 (A) se disolvió en una solución amortiguadora de citrato con pH 3,0. (B) se disolvió en una solución amortiguadora de succinato con pH 6,0. Se muestran los valores de TM y T½ para cada caso.
La Figura 6 muestra el valor del pico principal de TM a T=0 para el anticuerpo X en la detección inicial de preformulación y la Figura 7 muestra el termograma para el anticuerpo X en una solución amortiguadora de citrato con pH 3 y la solución amortiguadora de succinato con pH 6. Desde los valores de TM medidos, las condiciones de solución amortiguadora más estables (mayor TM) se encontraron entre el pH 5,0 y pH 7,5. A T=0, con otros métodos de análisis (UV, cromatografía de exclusión por tamaño [SEC], dispersión de luz y SDS-PAGE), se observó mucha menos discriminación entre las condiciones de solución amortiguadora en comparación con la DSC (los datos no se muestran aquí).
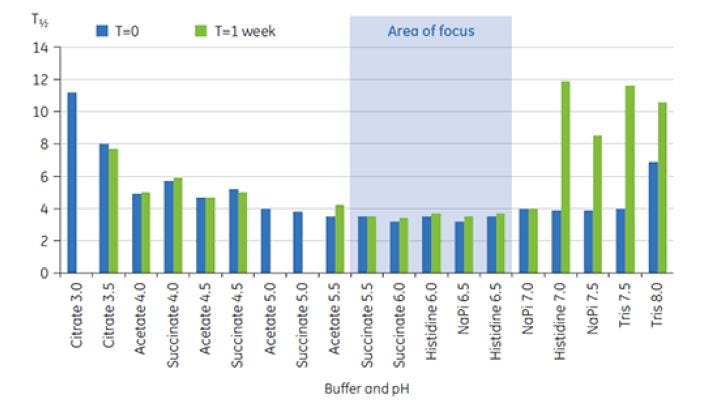
Figura 8: rango de valores de T½ para la transición de TM principal del anticuerpo X en soluciones amortiguadoras de preformulación en la semana a T=0 y T=1.
Los valores de T½ se utilizaron para discriminar entre las condiciones de formulación, como se indica en la Figura 8. La T½ es el ancho del pico a la mitad de la altura máxima para la transición más grande en el termograma de DSC y normalmente refleja la cooperatividad de la transición térmica. Un menor valor de T½ puede indicar una estructura más compacta y, por lo tanto, se prefiere para formulaciones. Aquí, el valor de T½ más bajo después de una semana de almacenamiento se encontró en soluciones amortiguadoras con valores de pH entre 5,5 y 6,5 (Figura 8). Estos datos se usaron para calificar las soluciones amortiguadoras adecuadas y el intervalo de pH apropiado para las pruebas posteriores con excipientes, lo que redujo considerablemente el número de condiciones exploratorias. En este estudio se demostró que la DSC se puede usar para optimizar rápidamente las condiciones de pH y de soluciones amortiguadoras para el desarrollo de preformulaciones.
Un producto biofarmacéutico también se caracteriza en diferentes soluciones amortiguadoras y excipientes para conocer las potenciales vías de degradación de proteínas. Esta información ayuda a desarrollar la formulación final. Normalmente, los medicamentos biofarmacéuticos no se degradan cuando se almacenan en un refrigerador durante el desarrollo de la formulación, por lo que, con frecuencia, se realiza un estudio de estabilidad acelerador de estrés por temperatura, como se indica anteriormente en varios ejemplos. En un estudio realizado por Zheng et al.[28], se examinó la degradación del anticuerpo monoclonal terapéutico IgG1 mAb-A. Este grupo primero evaluó el mAb-A en diferentes soluciones amortiguadoras (fosfato sódico, citrato sódico y acetato sódico), diferentes concentraciones de NaCl (20 mM y 100 mM) y diferentes valores de pH (pH 4,5, 5,5, 6,5 y 7,5) con MicroCal VP-Capillary DSC. Sobre la base de los valores más altos de TM y Tde inicio, se seleccionaron los candidatos de formulación más prometedores de cada grupo de solución amortiguadora para realizar más evaluaciones: fosfato sódico con pH 6,5 más 20 mM de NaCl, citrato sódico con pH 6,5 más 20 mM de NaCl y acetato sódico pH 6,5 más 20 mM de NaCl. El mAb-A en estas tres soluciones amortiguadoras arrojó valores de TM y Tde inicio similares, así como perfiles de termograma de DSC casi idénticos. Como una comparación, este estudio examinó también una formulación en acetato sódico con pH 4,5 y 20 mM de NaCl, que tiene una transición térmica y TM más bajos.
Los autores almacenaron mAb-A en las cuatro formulaciones a 40 °C, y las proteínas se caracterizaron con SEC (para separar los productos de degradación de las proteínas nativas), DLS (para determinar el segundo coeficiente virial modificado con el fin de caracterizar las interacciones proteína-proteína), cromatografía de líquidos con espectrómetro de masas (LC-MS, por sus siglas en inglés) (para secuenciar los productos de degradación), cromatografía de interacción hidrofóbica (para separar los productos de degradación de las proteínas nativas) y SDS-PAGE (para determinar los pesos moleculares de los productos de degradación). Se encontró que el almacenamiento en una solución amortiguadora con un pH de 4,5 generó más fragmentación en comparación con el almacenamiento en la misma solución amortiguadora con un pH de 6,5. Además, el almacenamiento con un pH de 4,5 indujo el despliegue del dominio de CH2, lo que aumentó la accesibilidad a la superficie del mAb-A, que a su vez pudo haber facilitado la fragmentación. Aunque la DSC arrojó que la estructura conformacional del mAb-A en soluciones amortiguadoras de fosfato con pH 6,5, de citrato con pH 6,5 y de acetato con pH 6,5 eran similares, la DLS mostró que la potencia de la interacción proteína-proteína fue diferente en cada solución. Si se interpretan en conjunto, los resultados de este estudio indican que las interacciones proteína-proteína desempeñaron un papel importante en el control de la formación de agregación en mAb-A. Los autores también afirmaron que el conocimiento obtenido de este estudio fue útil para el desarrollo de formulaciones de mAb-A, pero que no se debe extrapolar a otros anticuerpos mAb.
La proteólisis de productos biofarmacéuticos durante la purificación y el almacenamiento también puede ser otro problema. Las proteasas de la célula huésped pueden afectar la calidad de proteínas recombinantes y también pueden generar la pérdida significativa de productos. Las proteínas parcial o completamente desplegadas son más propensas a la proteólisis en comparación con las proteínas plegadas. Las proteínas plegadas se pueden estabilizar mediante la adición de osmolitos para que no sufran proteólisis.
En un estudio realizado por Mueller et al.[29], se investigó el mecanismo de protección de la inmunoglobulina M (IgM) en contra de la proteólisis. Las IgM están emergiendo como candidatos terapéuticos, pero tienen la reputación de ser inherentemente inestables. En este estudio se añadieron las proteasas pepsina, papaína y α-quimotripsina a una IgM purificada, mAb 85, y se analizó la degradación en ausencia y presencia de excipientes. Con el uso de MicroCal VP-Capillary DSC, se constató un aumento en la estabilidad conformacional del mAb 85 como resultado de la adición de los excipientes glicina y sorbitol. El mAb 85 se desplegó en 2 a 3 transiciones térmicas según el pH de la solución amortiguadora, donde estas transiciones corresponden a diferentes dominios o áreas estructurales. Los valores de TM aumentaron considerablemente mediante la adición de un 20% de sorbitol o 1 M de glicina (aumento de 4 a 5 °C) o ambos (aumento de 7 a 11 °C) con un pH de 5,5 y pH 7,4. Esto plantea la pregunta de cómo se lleva a cabo la protección por parte del sorbitol y la glicina. Una posibilidad es que las proteasas se inhiben ante la presencia de estos excipientes, probablemente mediante la compactación de sus conformaciones estándar. Otra posibilidad es la compactación de la IgM, lo que hace la hace menos accesible para la división proteolítica.
Para dilucidar el mecanismo, se analizó la división proteolítica de sustratos con bajo peso molecular. Estos sustratos no se estabilizan mediante la compactación de su conformación a través del mecanismo de exclusión preferencial. La actividad de la papaína aumentó levemente, mientras que la actividad de la quimotripsina casi no cambió, lo que sugiere que es posible que los excipientes estabilicen la papaína sin reducir su actividad. Estos resultados indican que el efecto protector de los excipientes está mediado solamente por la estabilización conformacional del mAb 85, lo que puede incluir un aumento de la compactación y una posible reducción en la accesibilidad de los sitios de división para las proteasas. Por eso, es posible que la adición de excipientes como el sorbitol y la glicina a las soluciones amortiguadoras durante la purificación y la formulación ayude a reducir o incluso eliminar los requisitos para los inhibidores de proteasas en formulaciones de productos biofarmacéuticos.
Un artículo realizado por Morar-Mitrica et al.[30] proporciona un ejemplo de cómo la DSC y otros métodos biofísicos se pueden emplear para el desarrollo de formulaciones específicas para un sistema de dosificación especial. Otelixizumab es un mAb humanizado (IgG1) dirigido contra CD3 humanos. Dado que las dosis clínicas son bajas (0,1 mg a 0,5 mg por dosis), el medicamento se desarrolló con una concentración de 0,2 mg/mL. La administración de la dosis requirió la dilución del mAb en un envase de solución intravenosa que contiene una solución salina normal, seguido por la dosificación de los contenidos de todo el envase a través de una bomba de infusión. Esto generó concentraciones de proteína en el envase de solución intravenosa tan bajas como 0,002 mg/mL. Debido a la baja concentración de proteínas, hubo un alto riesgo de una pérdida significativa de proteínas por medio de la interacción con el envase de solución intravenosa o el sistema de la bomba de infusión. A través del desarrollo de formulaciones biofísicas convencionales y los estudios de estabilidad en uso, se desarrolló un medicamento que presentaba pérdidas adsortivas reducidas y degradación oxidativa reducida, y la formulación del líquido era estable bajo condiciones de refrigeración.
Para la prueba de formulación estándar, se determinaron los valores de TM para otelixizumab en presencia y ausencia de 0,1% de polisorbato 80 (PS80) a partir de un termograma de DSC. Los termogramas de proteínas en presencia y ausencia de PS80 fueron similares, con un perfil de despliegue consistente, lo que sugiere que no hubo cambios de HOS como una función de surfactantes. Por medio de DSC, se identificaron al menos dos especies/dominios, correspondientes a dos transiciones de despliegue. Los resultados de la DSC para el mAb en ausencia y presencia de PS80 no mostraron diferencias significativas ni en el TM1 ni el TM2. Además, PS80 no tuvo efecto en la estabilidad térmica del mAb, como lo indicó una comparación de otros parámetros termodinámicos relevantes derivados de la DSC, como la T1/2 y la entalpía total del despliegue.
Puede haber presencia de peróxidos en cantidades significativas en materias primas como los polisorbatos, lo que provoca un potencial daño oxidativo en productos biofarmacéuticos, que a su vez genera consecuencias, como una eficacia reducida y posiblemente, reacciones inmunogénicas no deseadas. Para evaluar el riesgo de oxidación como una vía de degradación significativa, se oxidó solo otelixizumab en una solución amortiguadora de histidina (sin PS80) por medio de un tratamiento con peróxido de hidrógeno, y se evaluaron los cambios estructurales inducidos por oxidación con DSC y se compararon con un control no oxidado. Con el análisis del TM, se observó una desestabilización inducida por oxidación de la primera transición de despliegue, normalmente atribuida al dominio de CH2 del mAb. Hubo una disminución significativa en el TM1 (la transición de temperatura baja) concomitante con la ampliación del pico. La segunda transición (TM2) no se vio afectada por la oxidación. El análisis de espectrometría de masa (MS) confirmó que un residuo de metionina expuesto en el dominio de CH2 fue 90% oxidado por peróxido. Con estos resultados se demostró que el sitio de más oxidación fue el residuo de metionina en el dominio de CH2 y que el evento de oxidación se correlacionó con la desestabilización termodinámica de este dominio. Los autores concluyeron que la administración de mAb terapéuticos en baja concentración presenta desafíos y que es fundamental que el desarrollo de formulaciones y los estudios de estabilidad vigentes se realicen en etapas iniciales del desarrollo.
Los resultados presentados en este documento demuestran con claridad la importancia de la efectividad de incorporar la DSC como un ensayo biofísico de estabilidad durante el desarrollo de preformulaciones y formulaciones. Con el uso de los resultados de DSC y otros ensayos de estabilidad, las empresas biofarmacéuticas pueden tomar decisiones informadas sobre las formulaciones más estables, lo que significa que la proteína es menos propensa a presentar problemas de estabilidad y agregación a largo plazo en su formulación final y como medicamento. Esto se traduce en una producción de medicamentos más rentable y una mayor probabilidad de que la formulación final del medicamento se mantenga activa, estable, segura y en una conformación correctamente plegada.
Analytical Techniques for Biopharmaceutical Development, R. Rodriguez-Diaz, T. Wehr, S. Tuck (ed.), Taylor & Francis, Nueva York EE. UU. (2005).
Biophysical Characterization of Proteins in Developing Biopharmaceuticals, D.J.Houde, S.A. Berkowitz (ed.), Elsevier, Amsterdam, Países Bajos (2015).
Biophysical Methods for Biotherapeutics: Discovery and Development Applications, T.K. Das (ed.) John Wiley & Sons, Hoboken Nueva Jersey EE. UU (2014).
Biophysics for Therapeutic Protein Development, L.O. Nahri (ed.), Springer Nueva York, EE. UU (2013).
State-of-the-Art and Emerging Technologies for Therapeutic Monoclonal AntibodyCharacterization Volumen 1. Monoclonal Antibody Therapeutics: Structure, Function, and Regulatory Space, J.E. Schiel, D.D. Davis, O.V. Borisov (ed.), ACS Symposium Series Volumen 1176 (2014). doi: 10.1021/bk-2014-1176.
State-of-the-Art and Emerging Technologies for Therapeutic Monoclonal Antibody Characterization Volumen 2. Biopharmaceutical Characterization: The NIST mAb Case Study, J.E. Schiel, D.D. Davis, O.V. Borisov (eds.), ACS Symposium Series Volumen 1201 (2015). doi: 10.1021/bk-2015-1201.
State-of-the-Art and Emerging Technologies for Therapeutic Monoclonal Antibody Characterization Volumen 3. Defining the Next Generation of Analytical and Biophysical Techniques, J.E. Schiel, D.D. Davis, O.V. Borisov (ed.), ACS Symposium Series Volumen 1202 (2015) DOI: 10.1021/bk-2015-1202.